ACADEMIA IBEROAMERICANA DE MEDICINA BIOLOGICA Y ODONTOESTOMATOLOGIA | home

Capítulo 7 - Regeneracion Tisular
REGENERACION TISULAR
Prof. Dr.Horacio Kinast Feliú
Director Academia Iberoamericana de Medicina Biológica y Odontoestomatología Sistémica
Director Ejecutivo Centro Nacional de Medicina Biológica de Chile.
Presidente Comisión Internet Sociedad Científica de Chile
" Se entiende por regeneración, la sustitución de los tejidos dañados o muertos por otros nuevos con la misma función. Se limita a la sustitución de células especializadas y su estroma, soporte y vascularización.
La reparación es la sustitución de los tejidos lesionados por proliferación de los que sobreviven en la zona, tanto especializados como no especializados.
La regeneración varía en cada tipo de tejido y la sustitución de tejido especializado depende de la extensión de la lesión.
Cuando hablamos de “ Regeneración de tejidos biológicos “, debemos tener presente en todo nuestro análisis , el proceso de tipo general , que utiliza el organismo , para regenerar o normalizar los tejidos corporales afectados.
E decir, no debemos olvidar jamás los procesos genéricos, para tratar de explicar los procesos específicos. Nunca un proceso específico se aparta del proceso central o genérico en los organismos vivos.
La Naturaleza, en primer lugar dentro de su sabiduría inmanente y de su capacidad de reequilibrar en forma constante al organismo humano , desarrolla siempre un mecanismo de tipo genérico, en base a archivos de memoria, los que actúan permanentemente en forma secuencial y a una velocidad poco imaginable por parte del ser humano.
Quien entiende del funcionamiento del ordenador o computadora, puede comprender fácilmente a su vez, este concepto de archivos de memoria y de algoritmo secuencial.
Un archivo de memoria, es un conjunto de ordenes , que se van enlazando en forma secuencial, una tras otra y generan a través de este proceso, una acción preestablecida, conocida y de resultados pre-esperados.
Cuando esto sucede, habitualmente hablamos de Normalidad o Equilibrio.
Cada ser humano posee su propio rango de equilibrio y sobre este rango único y prioritario se debe efectuar las diferentes terapéuticas destinadas a la regeneración tisular. Los conceptos genéricos, como su nombre lo indica, son de tipo general y sirven solamente como un mecanismo de orientación. No son aplicables al individuo.
En la actualidad existen numerosos exámenes que permiten verificar est rango ( calcio iónico ,magnesemia , estudios de pH, análisis de ácido láctico, electroacupuntura, etc).
Cuando analizamos estadísticamente el conjunto de normalidades de un determinado grupo humano, ya sea estructuralmente, genéricamente o étnicamente, hablamos de un “rango de normalidad”, lo que si bien entrega un informe de tipo genérico, no corresponde al individuo, sino que al grupo respecto al cual fue medido.
Ello nos obliga a los clínicos a tratar de “entender al caso clínico”, en lugar a asimilarlo a un grupo donde él paciente , corresponde a una individualidad propia y no un número mas dentro de la unidad de medición.
El análisis de tipo individual, que se obtiene de la observación detenida de cada caso clínico, es la clave para entender el comportamiento de la respuesta de ese individuo, ante una determinada injuria.
La claridad de este concepto , permite poder comprender la respuesta anómala durante la regeneración de tejidos orgánicos a consecuencia de una injuria casual o clínicamente provocada.
Este proceso, donde se van generando órdenes de tipo intra y extracelular, que permiten la neoformación de tejidos, técnicamente configura un algoritmo biológico que debe ser respetado o nos llevará indefectiblemente al fracaso.
Generalidades
El organismo humano , tal como lo ha demostrado la Ciencia en sus últimos descubrimientos, especialmente a través de la Biología Celular, Inmunología , Homotoxicología y otras ciencias actualmente vigentes, es una sola unidad biológica y por ello existe lo que denominamos como “ Proceso Sistémico” .
Esto nos facilita comprender las manifestaciones de respuesta del organismo ante cualquier situación y el por qué cada respuesta, ante un mismo tipo de injuria, puede ser diferente entre uno y otro individuo (queloides , alveolitis, rechazos,etc)
Biológicamente en todo individuo, existe lo que denominamos el Punto de Menor Resistencia o Locus Minor Resistencae, que es el punto orgánico , donde prevalecerán las patologías y ello se deriva de la embriología, a través de la capa prevalente derivada de la Gástrula Tridérmica (ectodérmica,mesodermica,endodérmica y sus respectivas subdivisiones) , durante la evolución desde este punto, a la condición de embrión y luego a la de adulto.
La dominancia de tipo genético , explica las potencialidades de heredar tendencias a determinas patologías, pero no necesariamente a hacerlas.
Los componentes propios del cuerpo humano, también tienen cierta importancia , para nuestros análisis del enfermo , previos a cualquier tipo de intervención.
Como un ejemplo de ello, tenemos los oncogenes, que los posee toda la especie humana. Pero ello no significa que toda la especie humana vaya a padecer de cáncer. Para ello se necesita agregar factores predisponentes y factores desencadenantes y además la necesaria desestabilización de los genes estabilizantes , como ser el Gen P-53 y el Gen P-Mic.
El Medio extracelular.-
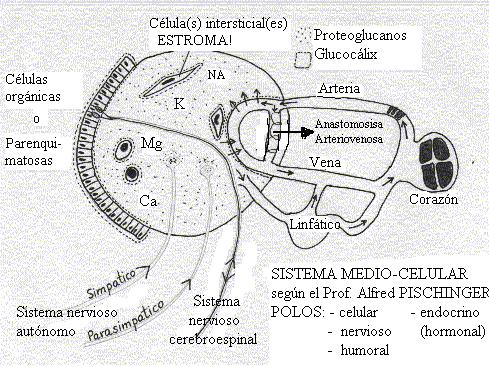
El factor común en el organismo humano es lo que desde el año 1975 se conoce , como Espacio Básico o Medio Celular de Pischinger , que configura el 65% del peso corporal.
Este espacio, como su nombre lo indica, en condiciones normales. es de tipo neutro ligeramente alcalino y posee un pH 7.4. En este espacio se produce todo el intercambio intra y extracelular.
En este espacio se encuentran todos los terminales nerviosos, endocrinos, vasculares, linfáticos, simpáticos, parasimpáticos, etc. Allí es donde se producen los intercambios tanto nutricionales como de información de los distintos planos y componentes extracelulares.
Fig.1 Espacio medio o Celular Básico de Pischinger
Es en este medio donde encontramos tanto el líquido extracelular, como la matrix extracelular o matriz basal del organismo.
Cuando hablamos de regeneración tisular debemos incorporar a este concepto, tanto las diferentes células orgánicas , como la matriz y el líquido extracelular. En caso contrario el producto final de la regeneración tisular efectuadas será diferente de la normal esperada.
Por ello es indispensable conocer esta materia, para poder hablar con propiedad de regeneración tisular. En caso contrario solamente estaremos hablando de una parte del proceso y lógicamente recibiremos una respuesta biológica parcial
La matriz extracelular .-
La matriz extracelular es un tejido destinado, no solamente a sostener las diferentes células del organismo, sino que también a nutrirlas, recibir sus residuos metabólicos, filtrar estos y a la vez constituir el centro de mensajería de la información biológica.
Distribuye esta información a través de todos los canales disponibles del organismo, tanto los ya definidos anteriormente, como muchos otros , que en la Medicina Clásica, no manejamos ni comprendemos, como por ejemplo los canales de acupuntura de la medicina china, ya estudiados científicamente por Pomeranz y otros científicos.
Esta matriz o Matriz es de tipo dinámico y actúa como un filtro molecular de toxinas y residuos tóxicos durante 12 horas diarias, permitiendo la eliminación de estas toxinas llevándolas al sistema venoso y linfático y a través de estos y de la propia matriz a los órganos de eliminación o emuntorios. ( son órganos de tipo emuntorio, la piel, el cólon,las glandulas salivales y lacrimales, el pulmón, el riñón)
La falla o ineficiencia de la gestión biológica de cualquiera de estos componentes, influye negativamente en la respuesta biológica. Por lo tanto cuando se desea hablar de regeneración tisular se requiere previamente conocer el estado o capacidad de eliminación de toxinas del individuo. En caso contrario se corre el riesgo de no obtener el resultado clínico esperado originalmente.
Este es el motivo por el cual todo intento de regeneración o modificación de tejidos, debe hacerse sobre un organismo estabilizado.
Fig.2.-Neurona sobre matriz alterada ( no se observan dendritas)
Fig.3 Neurona sensorial del vómer
Cuando el medio o matriz extracelular y el líquido extracelular es adecuado, la respuesta biológica celular también es correcta.
La matriz extracelular está compuesta por una malla formada por proteínas e hidratos de carbono polimericos , conocidos como proteoglicanos y glicosaminoglicanos, y con proteínas de tipo estructural ( colágeno, elastina,etc) y con proteínas de tipo reticular (fibronectinas,lamininas y otras ) ,elementos estos , que son de tipo dinámico y están actuando constantemente y que permiten la vida. ( Esto se conoce en la actualidad como Fenómeno de Regulación Basal )
Uno de los principales componentes es el ácido hialurónico cuya actividad la destacamos solamente, como un ejemplo de estas moléculas.
A-1.- El Acido Hialurónico
El ácido hialurónico es un componente extracelular del tejido conectivo que controla el estado de hidratación y el tráfico de macromoléculas en la matriz tisular e interviene especialmente en la regeneración post inflamatoria, con actividad específica en la migración de los fibroblastos y la fibrogénesis.
Se ha utilizado como tratamiento de diversas afecciones inflamatorias de la rodilla y la articulación temporomandibular con buenos resultados. El ácido hialurónico endógeno se encuentra presente en concentraciones elevadas en el tejido gingival, donde participa en la reparación tras intervenciones odontológicas y en el restablecimiento de la estructura tisular tras una gingivitis, por lo que se ha estudiado su aplicación tópica como tratamiento de la enfermedad periodontal. Los estudios clínicos realizados han mostrado buenos resultados, con un alto grado de tolerabilidad y aceptabilidad por parte de los pacientes, lo que permite predecir un buen uso terapéutico de este fármaco en el tratamiento de la gingivitis, una enfermedad de alta prevalencia en la población general.
A.-2.- Papel fisiológico del ácido hialurónico
El ácido hialurónico (AH) es un glicosaminoglicano de alto peso molecular que se encuentra en la matriz extracelular del tejido conectivo e interviene en la cohesión tisular. Es el glicosaminoglicano más abundante en la matriz extracelular de los tejidos periodontales.
El ácido hialurónico es un componente de la matriz del tejido conectivo, especialmente en las encías . Es un polímero de ácido glucurónico y N acetilglucosamina unidos alternativamente por enlaces glucosidicos que interacciona con otros proteoglicanos y el colágeno para dar estabilidad y elasticidad a la matriz extracelular del tejido conectivo.
El ácido hialurónico se une mediante enlaces de hidrógeno a diversas proteínas y moléculas de agua para formar un macroagregado viscoso que se encarga especialmente de regular la inflamación.
El ácido hialurónico presenta un importante efecto antinflamatorio, antiedematoso, cicatrizante y elasticizante que ya han sido demostrados en otras indicaciones . Asimismo, se ha estudiado su utilidad en el tratamiento tópico de las gingivitis, con la ventaja de que su adhesividad mantiene su efecto tópico localizado sobre las encías en que se aplica.
A.-3.- Actividad farmacológica del ácido hialurónico
El ácido hialurónico es un glucosaminoglicano de alto peso molecular que se encuentra en la matrizextracelular del tejido conectivo e interviene en la cohesión tisular.
Es el glucosaminoglicano más abundante en la matriz extracelular del tejido conectivo, especialmente en los tejidos dentales y periodontales, y tiene como importante propiedad física su capacidad de embeberse en agua hasta aumentar más de 50 veces su peso seco, lo que da a la matriz tisular un alto grado de compacidad que favorece el tráfico de gases y moléculas pequeñas, pero que actúa de barrera al paso de macromoléculas y cuerpos extraños.
Sin embargo, durante los procesos inflamatorios se produce una despolimerización progresiva que altera la arquitectura del tejido y dificulta los intercambios metabólicos.
A.-4.- La vida en el ser pluricelular
La vida de un organismo pluricelular evolucionado depende de la tríada formada por el sistema capilar (incluyendo vasos linfáticos ) la matriz extracelular y la célula.
Toda célula se encuentra en constante interacción con su entorno.
La matriz extracelular en su condición de filtro molecular forma parte del sistema integral energético abierto que es el organismo y el material genético celular depende del correcto funcionamiento de la matriz.
Consecuentemente la matriz extracelular ocupa todos los espacios extracelulares del organismo y ello es lo permite comprender el concepto de “ unidad biológica”
Su constitución es siempre la misma, pero no siempre es igualmente homogénea y depende de cada estructura orgánica ( hueso, cartílago, tejido cerebral, etc.)
Esta combinación de proteínas ( que forman la red) y azúcares que rellenan los espacios de esta malla se unen al glicocalix de la célula a través de los azúcares de la membrana celular.
Los azúcares se encuentran en los lípidos y proteínas de la membrana celular (glicolípidos y glicoproteínas) y forman una película superficial típica del individuo y de la célula.
En esta película, se encuentran la totalidad de los receptores de membrana, moléculas de adhesión celular, integrinas, sustancia básica de los grupos sanguíneos y antígenos de histocompatibilidad.
Esto permite los llamados fenómenos de apoptosis o reconocimiento celular
Fig.4. Proceso de Apoptosis
Los componentes del glicocalix se encuentran en interacción con los segundos mensajeros de la cara interna de la membrana celular y/o el citoesqueleto. Estos componentes son los que permiten la transmisión de la información intracelular a través de la matriz ( Harmut Heine 1997)
B.-Regulación basal.-
Por el filtro molecular de la matriz consistente en proteaoaminoglicanos, glucoaminoglicanos, proteinas reticulares y estructurales , debe pasar todo el metabolismo, constituyendo con ello la via de transito.
Las terminaciones ciegas neurovegetativas en la matriz, hacen que esta se encuentra conectada directamente al sistema nervioso central. La conexión endocrina a la efectúa a través de los capilares. Ambos sistemas se encuentran conectados directamente al hipotálamo.
Los componentes de glucoaminoglicanos y proteoglicanos debido a la carga negativa de sus cadenas de azúcares tienen afinidad directa para captar agua e intercambiar iones asegurando la isotonía, iososmía e isoionía, asegurando el equilibrio de la matriz. (Heine 1997).
Esto componentes proteicos y azúcares participan en el control espacio temporal autocrino y paracrino de todos los procesos celulares gracias a su capacidad de unir y liberar citoquinas y factores de crecimiento ( Heine 1997)
Como un ejemplo de esta gigantesca capacidad de formar portadores de información ( Sharon y Lis,1993), cuatro azucares simples, pueden generar 35.560 tetrasacáridos diferentes mientras que cuatro aminoácidos solamente pueden llegar a formar 24 tetrapéptidos diferentes.
Los genes solamente disponen de 20 aminoácidos para la síntesis de proteínas que se codifican en tripletes ( adenina , guanina , histidina y timina). Esto permite hasta 64 combinaciones. La matriz en cambio por su elevada capacidad de información es lo que permite hacer uso de las memorias temporales a través de un rápido intercambio metabólico y múltiple posibilidad de enlaces de los azúcares.
Esto último es lo que permite una ordenación individual y reproducible independiente del equilibrio termodinámico (Heine 1997)
C.-Ordenación por ritmos .-
Todo sistema biológico es energéticamente abierto y absorbe la energía de sus nutrientes y liberan a su vez, residuos de energía.
Todo sistema abierto es realimentado y oscilante, lo que permite el ajuste y adaptación constante manifestando un comportamiento no lineal, lo que le permite autoajustarse. La excesiva realimentación a la entrada de un sistema puede producir sobrecarga y cambios no esperados.
Por esta razón el secreto de la biodiversidad es la no linealidad. En ello radica igualmente el proceso de la regeneración tisular.
Los sistemas biológicos al ser energéticamente abiertos, son lábiles y se autorregulan en forma espontánea. Son estimulados por procesos bioquímicos intracelulares y extracelulares por los cambios de ritmo de la matriz. Estos mismos
ritmos del plano molecular se extrapolan a ritmos perceptibles tales como el pulso coronario, ritmo peristáltico y así sucesivamente. Estos ritmos biológicos o bioritmos son de alta importancia en su sincronización para el comportamiento o respuesta biológica.
D.- Equilibrio electrolítico .-
El funcionamiento de las membranas celulares se efectúa, a través de intercambio de iones y equilibrio de estos entre sí. Es así por ejemplo que para el correcto funcionamiento del tejido muscular, se requiere de una relación exacta de 2 : 1 entre el calcio iónico y el magnesio. El desequilibrio entre ellos produce arritmias, contracturas isométricas y depleción entre ellos. Cuando este tipo de tejidos es el que debe ser regenerado, es indispensable considerar esta condición biológica.
En el caso del tejido óseo se debe considerar tanto el equilibrio de tipo electrolítico, como el aporte nutricional para los diferentes tejidos que constituyen el hueso, como ser, calcio, fósforo, magnesio, fluor, las proteínas que forman el osteoid ,etc.
El desconocimiento del estado del equilibrio biológico facilita la progresión de errores en el proceso reparativo y no siempre el resultado negativo es la consecuencia directa de la técnica utilizada, sino que del estado biológico.
Los niveles de electrolitos, son un procedimiento obligado de considerar en todo intento regenerativo, para trabajar científicamente.
E.- Equilibrio lipídico .-
Otro elemento a considerar en el proceso de regeneración tisular , es el equilibrio lipídico, ya que de la correcta proporción de ácidos grasos esenciales se derivará la correcta constitución de las membranas celulares.
Por esta razón es indispensable el estudio del perfil lipídico del paciente.
Cuando el HDL se encuentra bajo, se producen trastornos de tipo vascular periférico, con mala irrigación local y mala cicatrización. Esto favorece el rechazo tisular y los secuestros óseos.
El aporte de elementos de tipo estimulantes y normalizadores de la función hepática son altamente positivos para la regeneración tisular, ya que es el hígado el órgano responsable de la detoxificación , puesto que es el responsable de la transformación de homotoxinas en homotoxonas, elementos estos últimos que son eliminables.
Hoy en día también sabemos que nuestro hígado es capaz de regenerarse, propiedad tisular que nos permite la posibilidad de llevar a cabo transplantes hepáticos en el quirófano moderno.
Cuando utilizamos en clínica productos regeneradores hepáticos, podemos observar como este noble órgano, va aceptando el desafío y comienza a regenerarse. Para ello previamente es indispensable provocar un proceso de desintoxicación del órgano y utilizamos los drenadores hepáticos.
Todo órgano es capaz de regenerarse y solamente varía el tiempo requerido para lograrlo. Ya sabemos que incluso el tejido nervioso es capaz de regenerarse y vemos los experimentos del Programa de Regeneración de Médula Espinal sel Miami Project del Hospital Jackson Memorial de Florida, donde ya se aprecia regeneración del órgano a los 30 días de iniciado el proceso
Fig.4.- Regeneración de tejido médula ósea
Nuestra labor en regeneración del nervio facial nos ha demostrado la enrome capcidad autoregeneradoras del tejido nervioso, cuanmdo este tejido es detoxificado y normalizado en su aspecto nutricional.
Fig.5.- Normalización nervio facial en 30 dias
Estas consideraciones deben formar parte de nuestro concepto actual sobre regeneración tisular y forman parte de los denominados “ conceptos genéricos sobre regeneración de tejidos “
F.-Regeneración tisular osteoarticular
El proceso de regeneración osteoarticular es en la actualidad un proceso superado, gracias a los aportes de la terapia de normalización electrolítica , adicionada de una alimentación sana y del ejercicio. Ya es ampliamente conocido el hecho de que el hueso se regenera por si mismo si se aplican los estímulos y nutrientes adecuados.
La comprensión del proceso osteoclástico derivado del conocimiento actual,de que el osteoclasto es una célula del sistema inmune derivada del fibroblasto de la matriz extracelular, ha roto con el esquema clásico de que se trataba de una célula ósea. Por lo tanto las alteraciones de la matriz extracelular pueden activar a los osteoclastos, los que proceden por si mismo a eliminar hueso al considerar a éste como un tejido extraño.
Ello sucede en forma regular o habitual en el hueso maxilar , derivada de inflamaciones de tipo crónico. No debemos olvidar que toda inflamación es en sí, un proceso de defensa del organismo.
La lógica pregunta que debemos hacernos ante este tipo de problemas es ¿ de qué nos estamos defendiendo?, en lugar de preguntarnos ¿ qué técnica será mas adecuada para eliminar esta inflamación ¿
La comprensión del concepto de prioridades del organismo, es otro factor importante a considerar, cuando se pretende efectuar regeneración tisular. En su adecuada aplicación se encuentra la diferencia entre el éxito y el resultado negativo
La primera prioridad del organismo, es sin duda alguna la de mantener vivo al individuo. Toda otra gestión es de tipo secundario.
El mantenimiento de la vida, se encuentra centrado en la relación contractura del músculo cardíaco y relajación posterior en forma cíclica. La detención del músculo cardíaco significa el fin de la vida.
Debido a esta razón de tipo biológico, cuando falta alguno de los elementos reguladores del ritmo cardíaco, como son el ión calcio y el ión magnesio, el organismo, para seguir adelante con el ciclo vital, retira estos elementos de cualquier órgano donde lo encuentre y lo redirecciona hacia el músculo cardíaco.
En esta forma se produce la salida de calcio, fósforo, magnesio de los tejidos ricos en estos elementos, el hueso entre ellos , para cubrir la demanda cardíaca.
Por esta razón cuando se busca la regeneración tisular del hueso, es imprescindible el mantener niveles aceptables y en lo posible altos de iones calcio y magnesio y a la vez controlado el ión fósforo. En caso contrario, ante cualquier demanda temporal de estos elementos minerales, el hueso en regeneración se verá prioritariamente afectado.
Este es un concepto que se debe tener muy en claro en el tratamiento de las patologías osteoarticulares y en las terapias de oseointegración , debido a su potencialidad como factor causal de fracasos .
G.-Regeneracion vascular : Lo mas novedosos frente al concepto de regeneración de vasos sanguíneos lo demuestra el siguiente artículo :
"
El gen HIF-1a induce por sí solo induce por sí solo la formación de vasos sanguíneos
|
Un equipo de la Universidad de California en San Francisco ha descubierto una nueva forma para generar vasos sanguíneos. Según las conclusiones del trabajo, el gen HIF-1a puede inducir por sí solo la formación de nuevos conductos sanguíneos en ratones de laboratorio. El hallazgo podría tener importantes implicaciones en el tratamiento de enfermedades vasculares periféricas, diabetes y heridas.
 |
El ratón transgénico generó más capilares nuevos.
|
Científicos de la Universidad de California en San Francisco (UCSF) han descubierto la forma más eficaz, hasta el momento, de generar nuevos conductos sanguíneos sanos, un descubrimiento con importantes implicaciones terapéuticas para el tratamiento de afecciones vasculares periféricas, diabetes y heridas profundas.
El estudio, publicado en el último número de la revista Genes & Development, revela que la expresión continuada de un solo gen, el HIF-1a, puede inducir la formación de nuevos conductos sanguíneos en ratones de laboratorio.
La proteína HIF-1 contiene una subunidad de la proteína factor 1 inductora de hipoxia (HIF-1). El HIF-1 regula la actividad de numerosos genes que promueven la angiogénesis en respuesta a la privación de oxígeno.
En sus experimentos, los investigadores, coordinados por Jeffrey Arbeit, de la UCSF, generaron una cepa de ratones que expresaban continuamente el gen humano HIF-1a, en concreto en las células de la epidermis, por lo que siempre tenían altos niveles de HIF-1 activo en su piel.
En condiciones de oxigenación normal, estos ratones transgénicos aumentaban la formación de capilares de la piel de forma notable a simple vista.
La mayoría de los intentos anteriores de generar nuevos vasos sanguíneos se han centrado en la sobreexpresión de VEGF, un factor de crecimiento importante en la formación de nuevos conductos sanguíneos. Pese a que una expresión aumentada de VEGF induce la angiogénesis, los conductos resultantes son débiles y se asocian con graves edemas e inflamaciones.
El nuevo método presentado en este estudio demuestra que el sistema vascular inducido por el HIF-1a es estructuralmente indistinguible de los vasos normales y no está asociado a ningún efecto adverso.
Nueva función
Por otro lado, la revista Science ha publicado en el último número dos estudios que revelan una función, hasta ahora desconocida, de los conductos sanguíneos en fase de formación en el desarrollo de los órganos, antes de que la sangre empiece a circular por ellos.
Científicos de la Universidad de Osaka, en Japón, han descubierto que los embriones de ratones con mutaciones en el gen flk-1, que carece de células maduras que transporten la sangre, no pueden desarrollar el hígado. Confirmaron estos resultados con experimentos en tejidos hepáticos cultivados fuera del organismo y vieron que la presencia constante de las células de los vasos sanguíneos era necesaria para el desarrollo del hígado. La constatación se realizó empleando un potente inhibidor del crecimiento de los conductos sanguíneos en órganos hepáticos en formación extraídos de los embriones de ratones.
El otro estudio, realizado por científicos del Howard Hughes Medical Institute, en Estados Unidos, utilizó ratones transgénicos con una sobreabundancia de células de conductos sanguíneos para demostrar que estas células proveen las señales necesarias para el desarrollo del páncreas y la expresión de la insulina.
G.-Terapias tradicionales de regeneración tisular en el campo odontológico.-
En el campo odontológico, los problemas mas frecuentes corresponden a los tejidos óseos y gingivales. Pero , sin embargo no se deben dejar de lado los componentes vasculares y nerviosos que corresponden a la microcirculación del área.
Como un ejemplo, el sangramiento gingival se encuentra íntimamente relacionado con la carencia de calcio iónico ,por una parte y con un desequilibrio lipídico y proteico por otro.
La presencia de sarro duro dental es una clásica forma de presentación de los trastornos derivados de la falta de calcio iónico. Sabemos que el calcio coloidal que no es reciclable, se elimina por la saliva y orina formando la base de las litiasis
La presencia de saburra lingual en la parte posterior de la lengua, corresponden a una deficiencia del metabolismo de las grasas.
Como todos estos elementos son componentes de tejidos nobles, es importante considerar el equilibrio de ellos, para obtener una buenas regeneración tisular.
Entre las terapias en boga en la actualidad se encuentra la llamada distracción osteogenica guiada. Esta terapia es muy bien comprendida por los ortodoncistas, ya que desde hace mas de 100 años producen desplazamiento y transformación de los maxilares sin problemas de ninguna especie.
La expansión maxilar guiada por el ortopedista es una maniobra habitual de excelentes resultados, Se encuentra basada en los principios de que la compresión sobre el tejido óseo provoca la eliminación de éste y la tracción sobre el hueso , genera a su vez nueva masa ósea.
Cuando a este concepto, se agrega la Cirugía, se puede acelerar el proceso, pero siempre que la tensión provocada no supere los 25 gramos para evitar dañar el ligamento periodontal . En su práctica habitual, el Ortodoncista utiliza materiales que automáticamente dejan de funcionar cuando se superan los 20 gramos. Ello se denomina como “ memoria del material”.
A fines de la década del 60 ya utilizábamos este concepto en el Hospital Ramón Barros Luco Trudeau, el nuestro Servicio de Ortodoncia, bajo el nombre de disyunciones palatinas, donde provocábamos expansiones maxilares de mas de 10 milímetros utilizando aparatos mecánicos conocidos como " disyuntores palatinos". Por lo tanto el manejo de tipo óseo de crecimiento y regeneración asistida por el profesional ya era una metodología de rutina. Estimamos que el concepto actual de distracción ósea guiada es solamente el cambio de nombre de una técnica clasica aplicada en esta oportunidad a la Periodoncia. Ello no le resta importancia ni méritos a la Distracción Osteogénica Guiada de la actualidad.
El término Distracción Osteogénica de gran actualidad en estos días, hace referencia a lo que ocurre exclusivamente en el hueso con este tipo de terapia. No considera ninguna de las variables anteriormente indicadas , las que ya utilizábamos en el Centro Nacional de Rehabilitación Oral del Hospital Ramón Barros Luco Trudeau del Ministerio de Salud de Chile en 1971.
Es importante dejar claramente establecido que en este tipo de terapias , se encuentran involucradas la matriz extracelular, el tejido conectivo, el tejido muscular, los ligamentos y articulaciones de la zona.
Por otro lado los resultados esperados dependen además de las fuerzas aplicadas y de la dirección o vectores de distracción dispuestos por el clínico y la intervención sistemática de quien active los dispositivos. Lo cual hace que ello pueda denominarse como un mecanismo dirigido.
H.- Historia de la Teoría de Distracción Osea.(DGT) (según Dr. Juan Fernando Aristizábal P., Dr. David Francisco Gómez G.
“ Codivilla en 1905 y posteriormente Abbott en 1927 fueron los primeros en reportar alargamiento de huesos largos mediante DTG.
Sin embargo, la alta morbilidad, el edema, la necrosis de piel, infecciones y los resultados impredecibles de las zonas de distracción impidieron que la técnica fuera aceptada ampliamente hasta la década del 50, cuando Gavril Ilizarov comenzó sus investigaciones en distracción dentro del campo de la Traumatología y ortopedia demostrando que la tracción gradual de los tejidos vivos crea fuerzas que mantienen y estimulan la regeneración y el crecimiento, lo cual se conoce como la ley de Tensión-Estrés.
A nivel craneofacial, Snyder y col(1973) reportaron experimentalmente alargamientos mandibulares con distracción, hallazgo que fue posteriormente corroborado por otros autores, conformando la morbilidad mínima del procedimiento (Karp y col., 1990).
Clínicamente, Guerrero y col (1990) han aplicado técnicas de distracción mandibular en el área de la sínfisis de pacientes con deficiencias transversales mandibulares y McCarthy (1992) ha reportado su experiencia en pacientes con hipoplasia mandibular tratados con distractores externos.
Desde la fecha existen en la literatura numerosos reportes documentando la validez científica y el éxito morfológico del procedimiento no sólo en mandíbula, sino también en bóveda craneana, maxilar, órbita y dientes."
Este tipo de terapias las efectuabamos ya, bajo la dirección del Dr. Jaime Contardo L. a fines de la década del 60 en la Cátedra de Cirugía de Cabeza y Cuello del Profesor Leonidas Aguirre Mc.Kay de la Escuela de Medicina de la Universidad de Chile. El Dr. Jaime Contardo, eximio cirujano máxilo facial fue discípulo del Prof. Obwegesser de Suiza. Al autor de este documento le correspondía solamente la normalización de la parte oclusal como ortodoncista y ortopedista del equipo multiprofesional.
I.-ASPECTOS BIOLOGICOS DE LA TEORIA DE DISTRACCIÓN OSEA GUIADA
( según Dr. Juan Fernando Aristizábal P., Dr. David Francisco Gómez G. )
Concepto del efecto de tensión - estrés
Ilizarov fue el primero que identifico los factores biomecánicos responsables de la formación ósea en Distracción Osea Guiada bajo el concepto del efecto de tensión - estrés. El estrés mecánico del estiramiento tisular estimula y mantiene la regeneración del crecimiento activo tisular produciendo una actividad metabólica, la que por un incremento en las funciones proliferativas y biosintéticas, promueve la vasculogénesis y la formación ósea (Ilizarov, 1992).
A nivel craneofacial, Michieli y Miotti (1977), McCarthy y colaboradores (1992, 1994) así como Guerrero y colaboradores (1995) entre otros, han comprobado experimental y clínicamente que el efecto observado en los huesos endocondrales es reproducible en los huesos intramembranosos (mandíbula) seguido los mismos mecanismos biológicos observados en huesos largos.
Estos resultados también han sido reproducidos clínicamente en Maxilar y tercio medio de cara (Polley y Figueroa, 1997; 1998), órbita y dientes (Liou, 1998).
J.-VARIABLES QUE AFECTAN LA DISTRACCIÓN OSEA GUIADA
(según Dr. Juan Fernando Aristizábal P., Dr. David Francisco Gómez G. )
a. Edad.
b. Soporte vascular y graso de lesión tisular durante la cirugía.
c. Sitio de Osteotomía.
d. Periodo de latencia.
e. Velocidad y frecuencia de la distracción.
f. Estabilidad del distractor (Mehrara y col, 1997).
K.-EFECTOS DE LA DISTRACCIÓN OSEA GUIADA EN TEJIDOS BLANDOS Y ARTICULACIONES
Nervios:
Mientras que los estudios realizados por Ilizarov muestran que los axones neuronales elongados recuperan la membrana mielínica completa en 3 semanas, otros estudios muestran evidencia histológica de desmielinización e inflamación axonal en el 9-15% de las fibras. Todas las fibras recobran su apariencia normal 60días después de terminar la DTG (Mehrara y colaboradores, 1997).
Músculos :
La literatura muestra resultados controversiales sobre el efecto de la DTG en los músculo.
Algunos reportes muestran hipertrofia y aumento de las organelas intracelulares de los miocitos, formación del nuevo tejido muscular y aumento en el número de células proliferativas y en el peso muscular después de 28 días de distracción.
Sin embargo estiramientos musculares de más del 10% producen daños irreversibles como fibrosis endomisial, internalización de núcleos pérdida de miofibrillas y atrofia del recubrimiento de sarcolema.
En mandíbula, los cambios producen atrofia del masétero y digástrico por reducción en la síntesis proteica (Mehrara y col, 1997; Fisher y col 1997).
Vasos sanguíneos
Incrementos del 20% de la longitud del vaso producen edema tisular, adelgazamiento de la tunica media, de los componentes elasticos y vacuolización de las células del músculo liso.
Estos cambios son más severos en venas y se resuelven espontáneamente 2 meses después de la distracción (Mehrara y colaboradores, 1997).
Articulaciones
Experimentalmente se ha encontrado aplazamiento del cóndilo ipsilateral y en menor grado del cóndilo contralateral asociado a los vectores de fuerza aplicados.
Clínicamente se observan incrementos totales en tamaño y volumen condilar en la fosa glenoidea, sin cambios contralaterales.
El códilo cambia su forma constantemente dependiendo de la dirección de los vectores de las fuenrazs que se aplican .Ello depende esencialmente de la forma de engranaje dentario.
Este efecto puede considerarse favorable porque compensa las normalidades en la ATM que representan los pacientes con microsomia hemifacial y condiciones similares.
La mayoría de los cambios son reversibles y están asociados al incremento de estrés en estas articulaciones, el cual no párese ser suficiente para producir cambios óseos tardíos que conduzcan a recidiva o a problemas articulares. (Mehrara y col, 1997; McCormick y col 1995 ).
En la Distracción Osea Guiada media mandibular existen cambios histológicos adaptativos asociados a las áreas de comprensión condilar que se generan por la rotación del cóndilo en su eje vertical (Harper y col. 1997).
L.- DISTRACCIÓN OSEA GUIADA MANDIBULAR
Indicaciones :
Pacientes con hipoplasias mandibulares unilaterales o bilaterales que hacen parte de anomalías como Microsomía hemifacial, Treacher Collins, Pierre Robin, deficiencias adquiridas debidas a facturas condilares tempranas o a trauma por proyectil, y deficiencias tranversales de la mandíbula.
Técnica :
Se han descrito protocolos con aparatos extraorales (McCarthy, 1992) e intraorales, para evitar las cicatrices cutáneas asociadas a procedimientos extraorales.
Los patrones de corticomías varían desde corticomías simples completas en el sitio de distracción (McCarthy, 1992) a corticotomías simples laterales conservando intacta la corteza medial (Molina y Ortiz-. Monasterio).
En la mayoría de los reportes los detalles metodológicos van de la mano con aquellos popularizados por Ilizarov.
La mayor parte de los clínicos esperan un periodo de latencia de varios días antes de iniciar la distracción mandibular.
Para determinar la dirección de la distracción, Losken y col (1995) han sugerido fórmulas matemáticas basadas en una evaluación cefalométrica preoperativa para mejorar la dirección de la distracción mandibular.
Después de la fase activa, se produce a la consolidación, en la cual normalmente se utiliza el aparato como una fijación rígida para permitir la maduración ósea. La duración de esta fase varia entre 6 a 12 semanas, según los diferentes protocolos.
Resultados :
Los resultados de la Distracción Osea Guiada de tipo Mandibular mandibular son promisorios. Tanto en casos unilaterales como bilaterales, diversos autores (Molina y Ortiz-Monasterio, McCarthy, Klein y Howaldt) han reportado distracciones entre los 23 y 50 mms, con mejorías en asimetrías faciales y con reportes de estabilidad hasta de 3.5 años.
Las deficiencias mandibulares adquiridas se pueden tratar también con la DTG. Shvyrkov y col (1995), han reportado su experiencia en 33 pacientes con heridas de arma de fuego, tratados por 12 días de compresión de los bordes óseos, seguido por una distracción del sitio de compresión.
M.-DISTRACCIÓN OSEA GUIADA MEDIOFACIAL
(Protocolo Centro Anomalías Craneofaciales Universidad De Illinois, Chicago)
Indicaciones :
Pacientes con labio y/o paladar hendido y anomalías del cráneo y tercio medio asociadas a síndromes específicos. La selección de los pacientes incluye:
1. Deficiencias severas, transversales, verticales y horizontales del maxilar
2. Avances anteroposteriores maxilares de mas de 8 a 10 mm
3. Pacientes con paladar hendido con cicatrices severas o colgados faríngeos.
4. Pacientes con labio y paladar hendido bilateral, que presentan premaxilas ausentes, rudimentarias o edéntulas.
Técnica :
Antes del procedimiento quirúrgico, se posiciona una férula rígida de acero de 0.045" unida a los primeros molares permanentes o segundos molares primarios, la cual se asegura con alambres interdentales. Los ganchos de tracción externa, se ubican extraoralmente a nivel del plano palatino, o en la posición vertical deseada.
Se utiliza una osteotomía tranversa alta tipo LeFort 1 de 2 o tres piezas según el grado de compromiso (LPH unilateral o bilateral) y se realiza además la disyunción pterigomaxilar y osteotomía septal. El maxilar se deja completamente móvil pero no es avanzado, reposicionado o fijado.
Inmediatamente después del cierre, se coloca un aparato rígido externo para distracción, asegurada con pines al cráneo.
No se requiere preparación quirúrgica especial para la colocación de los pines y solo se siguen procedimientos de aseo normal en la zona
Los alambres de tracción se conectan desde los ganchos externos de la placa intraoral a los tornillos de activación localizados en la barra horizontal del aparato de distracción. Tanto la barra horizontal como la barra vertical central que la sostiene son ajustables, permitiendo variar la dirección en un amplio rango. (Fig. 5 . La distracción se inicia entre el tercero o cuarto día postoperativo con una velocidad de 1mm por día. El aparato se deja para consolidación por 2 o 3 semanas y se remueve en el consultorio. La retención nocturna con máscara facial y tracción elástica se utiliza por 6 semanas.
Fig.5.-Distractor rígido externo inmediatamente después de su colocación quirúrgica. Cortesía Dr. L. Heffez)
|
Resultados
Los resultados de la distracción mediofacial, están aún en estadíos preliminares pero parecen ser promisorios.
Los pacientes con deficiencias maxilares severas presentan cuadros de hipoplasia en los tres planos del espacio (Vertical, horizontal y transverso), con un hueso maxilar displásico y muy delgado.
El tratamiento convencional Ortodóntico-Quirúrgico debe posponerse hasta la edad de maduración esquelética y en casos severos, los resultados pueden comprometer la estética del paciente.
En estas situaciones estaría indicada la Distracción Osea Guiada , donde los procedimientos pueden lograr avances significativos desde una edad muy temprana (Figura 6. )
Fig. 6.- Distracción frontomaxilar en un paciente con diagnóstico de Apert ( Cortesía CFC - U de Illinois, Chicago)
|
Toyh y Chin (1997), en pacientes con distracción mediofacial intraoral luego de una LeFort III para el tratamiento de deformidades craneofaciales complejas, reportan un promedio de 21 mm de distracción.
Molina y Ortiz-Monasterio también han reportado su experiencia utilizando osteotomias LeFort I, sin liberación de la fisura pterigomaxilar y utilizando máscara facial más un aparato intraoral.
Este tipo de terapias fueron iniciadas en Chile por el equipo dirigido por el Dr.Jaime Contardo L. en los inicios de la década de 1970 en el Hospital Ramón Barrios Luco Trudeau donde tuvimos el honor de trabajar conjuntamente.
N.- INDICACIONES Y VENTAJAS DE LA DISTRACCIÓN OSEA GUIADA
* Displasias severas donde los métodos tradicionales no pueden lograr resultados óptimos por la magnitud del problema
* Posibilidad de intervenir tempranamente sin esperar la maduración esquelética total.
* Elimina la morbilidad del sitio donante en los casos de injertos.
* Elimina la fijación postquirúrgica prolongada.
* Lesión nerviosa minimizada por utilización de tornillos monocorticales (Guerrero).
* Cirugía menos invasiva por la no movilización de los segmentos óseos.
O.-CONCLUSIONES Y PERSPECTIVAS FUTURAS DE LA OSEOINTEGRACION
El futuro de la distracción craneofacial es promisorio. En los pasados tres años, los cuestionamientos han pasado de: Debemos distraer? a: Que debemos distraer?.
En el campo de la Distracción Osea Guiada de tipo corporal, quien inició estos procedimientos fue el Dr.Teodor Malinin en Rusia y actualmente efectúa este tipo de terapias en el Hospital Jackson Memorial de Florida.
El grupo de Cirugía Ortopédica y Traumatología de Estambúl, esta trabajando en la utilización de clavos intramedulares, para mantener la longitud y el alineamiento de los ejes mecánicos y anatómicos del hueso.
En el campo de la Distracción Osea Guiada craneofacial, Sawaki en 1996 reporta la utilización de implantes oseointegrados para distracción mandibular y yamamoto (1997) los describe para distracción maxilar en reemplazo de los pines transcutáneos endóseos como un método de anclaje más rígido, adecuado para huesos maxilofaciales y sin secuelas como cicatrices faciales.
Más recientemente Liou y Col en 1998 reportan 15 pacientes, la distracción rápida del ligamento periodontal para retraer caninos en 3 semanas. El procedimiento abre perspectivas promisorias a lo que ellos denominan distracción dental.
P.- La Distracción Osea Guiada en Odontología.
La Regeneración Osea Guiada en Odontología es habitualmente manejada a través de recursos adicionales como ser las membranas, hules y otros elementos que destacamos a continuación.
El trabajo de Carlos Elvira, Alberto Gallardo, Julio San Román, Antonio López Bravo que destacamos explica las característica de estos elementos :
"Revisión actual de las familias de polímeros biodegradables de interés en medicina :
Atendiendo a su origen, se distinguen polímeros biodegradables de origen sintético y de origen natural.
Estos últimos pueden ser de naturaleza proteica, como el colágeno o la albúmina, o polisacáridos como la quitina y quitosano, los glucosaminoglucanos (heparina y ácido hialurónico, entre otros) o derivados celulósicos.
Entre los polímeros biodegradables sintéticos destaca, sin duda, la familia de los poliésteres alitáticos: poliácido láctico y pohácido glicólíco (poli-a-hidroxiácidos, los polímeros sintéticos de mayor éxito en medicina, junto a la polidioxanona, debido a su empleo en suturas reabsorbibIes), poli-£-caprolactona, polidioxanona y poli-Q-hidroxialcanoatos de origen microbiano.
Otros materiales sintéticos biodegradables son los polianhídridos y poliortoésteres (de gran interés en liberación de fármacos), poliaminoácidos, policianoacrilatos (adhesivos) y los politosfacenos.
Los biomateriales, cuando son aplicados en biomedicina, se pueden clasificar en dos grupos teniendo en cuenta el tiempo que deben mantener su funcionalidad.
En el primero se incluyen todos aquellos dispositivos que deben tener un carácter permanente, como son los sistemas utilizados para sustituir parcial o totalmente tejidos u órganos destruidos como consecuencia de una enfermedad o trauma.
En este caso, se necesitan materiales bioestables, ya que se supone que la situación ideal sería aquélla en que el biomaterial mantuviera su funcionalidad durante el resto de la vida del paciente.
El segundo grupo incluye a los biomateriales que deben mantener una funcionalidad adecuada durante un periodo de tiempo limitado, ya que el organismo humano puede desarrollar mecanismos de curación o regeneración tisular para reparar la zona o el tejido afectado.
Naturalmente, en estos casos un dispositivo temporal es necesario para sustituir durante un cierto período de tiempo la funcionalidad del tejido dañado.
Fig.-7 .- Cristales de apatita para relleno óseo
Básicamente, existen dos argumentos en favor de la utilización de sistemas temporales. Por una parte, la degradación constituye un mecanismo útil para eliminar el biomaterial después de haber concluido su función a través de una vía natural.
En segundo lugar, la degradación también ofrece la oportunidad de que pueda conseguirse un proceso de curación óptimo, con la recuperación total de la funcionalidad del sistema fisíológico, ya que ha de tenerse en cuenta que una tendencia natural del organismo humano o de cualquiera de sus componentes fisiológicos es la capacidad que desarrolla para adaptarse a su entorno.
A pesar de estas ventajas evidentes, los requerimientos exigidos a un material biodegradable son frecuentemente más severos que los exigidos a un material bioestable.
En primer lugar, no sólo los materiales de partida deben ser inocuos, sino también sus productos de degradación. En segundo lugar, las propiedades mecánicas mínimas requeridas a los materiales degradables para su uso como soportes en crecimiento de tejidos o en fijación de fracturas óseas deberían mantenerse durante el proceso de regeneración de los tejidos defectuosos.
En tercer lugar, tanto los productos de partida como los de degradación, no deberían entorpecer la regeneración tisular sino, en todo caso, acelerar el proceso de curación.
Por último, el implante debe ser esterilizable, es decir, el método de esterilización no debe de degradar severamente el implante.
Aunque se han estudiado un gran número de materiales biodegradables para su posible aplicación médica, hay muy pocos tipos de polímeros biodegradables que se usan en medicina, debido a los requerimientos tan restrictivos mencionados anteriormente.
En cuanto a su origen, los polímeros degradables se pueden dividir en naturales y sintéticos.
Se ha puesto especial énfasis en las aportaciones más novedosas y con mayores perspectivas de futuro en el terreno de la ingeniería de tejidos, es decir, en la utilización de matrices poliméricas degradables como soportes o andamiajes temporales para el cultivo celular y regeneración tisular.
Además se revisan las aplicaciones en cirugía, como suturas reabsorbibles, dispositivos temporales de fijación ósea o injertos vasculares, en la prevención de la adhesión postoperatoria, en problemas epiteliales (piel artificial) y en dispositivos de liberación de fármacos.
Entre estos últimos se pueden distinguir sistemas de tipo químico (fármaco unido covalentemente a la matriz polimérica) o de tipo físico (medicamento embebido físicamente en dicha matriz).
Actualmente se usan 4 términos diferentes (biodegradación, bioerosión, bioabsorción o biorreabsorción) para indicar que un material o dispositivo dado desaparecerá eventualmente tras ser introducido en un organismo vivo.
Sin embargo, en la literatura no existe una distinción clara en el significado de estos términos. De igual manera, el significado del prefijo "bio" no está bien establecido, dando lugar al uso, a menudo intercambiable, de los términos "degradación" y "biodegradación" o "erosión" y "bioerosión".
Aunque se han hecho esfuerzos para establecer definiciones aceptables que puedan ser aplicadas con carácter general en todos los aspectos del campo de los biomateriales1, todavía existe una importante confusión, incluso entre investigadores experimentados en este campo, acerca de la correcta terminología para definir los diferentes procesos degradativos.
En 1987 la Sociedad Europea de Biomateriales1 denominó "biodegradación" al proceso en el que un agente biológico (enzima o microbio) es el componente dominante del proceso degradativo.
Sin embargo, en 1991, se dio una definición más práctica de biodegradación (que es la que usaremos aquí), como la destrucción gradual de un material mediada por un sistema biológico, lo que implica que el sistema biológico no tiene por qué ser la causa del proceso degradativo sino solamente el medio en el que se produce.
Por otro lado, de acuerdo a la sugerencia de Heller podemos definir un polímero bioerosionable como un polímero insoluble en agua que se convierte bajo condiciones fisiológicas en un material (es) soluble en agua sin importar el mecanismo implicado en el proceso de erosión. "Bioerosíón" incluye, por tanto, procesos físicos (como disolución) y químicos (como rotura de la cadena).
En este caso el término "bio" indica que la erosión ocurre en condiciones fisiológicas, en contraposición con otros procesos de erosión causados, por ejemplo, por la alta temperatura, ácidos o bases fuertes, luz UV o condiciones ambientales.
El término "biorreabsorción" y "bioabsorción" se usan indistintamente y a menudo implican que el polímero o sus productos de degradación son eliminados por actividad celular (por ejemplo, fagocitosis) en un ambiente biológico.
Estos dos últimos términos son de alguna manera superfluos y no han sido definidos claramente.
Con estas premisas y de cara a facilitar su lectura, en este trabajo se usarán indistintamente las acepciones (bio) degradación, (bio) erosión y (bio) reabsorción.
“Los estudios sobre cicatrización periodontal basados en las investigaciones de Karring, Nyman, Lindhe (1980) y Caton (1980) han resultado en el desarrollo de una modalidad de tratamiento conocido como Regeneración Tisular Guiada y consiste en un procedimiento quirúrgico tendiente a retardar la migración apical del epitelio, prevenir el contacto de células del tejido conectivo gingival con la superficie radicular tratada y permitir que células originadas del ligamento periodontal migren y proliferen sobre la misma superficie radicular.
Todo esto mediante la colocación de una membrana que actúa como barrera física entre el colgajo mucoperióstico y la superficie radicular.
Por lo tanto, los procedimientos quirúrgicos regenerativos intentan modificar las variables que participan normalmente en los procesos reparativos y obtener de este modo la restauración ad integrum de los tejidos perdidos.
La interpretación de los resultados en los ensayos clínicos demuestra ganancias de inserción clínica que pueden ser estadísticamente significativas pero lo son clínicamente relevantes si esa ganancia constituye una verdadera regeneración periodontal.
Las ganancias de inserción y de hueso posterior a técnicas regenerativas son el resultado tanto de eventos reparativos como regenerativos. “
El principal problema con las evaluaciones clínicas de éxito es que éstas no distinguen entre fenómenos de reparación y regeneración. ( por Dr. Rodrigo Hidalgo Acosta. Trabajo de Investigación, Requisito para optar al Título de Cirujano Dentista, Cátedra de Operatoria Dental, Facultad de Odontología, Universidad de Valparaíso, 1998. * Cirujano-Dentistas, Promoción 1998, Facultad de Odontología,)“
El concepto biológico de la Regeneración Tisular Guiada (RTG),se basó en la necesidad de eliminar de la zona quirúrgica aquellos tejidos sin capacidad regenerativa (epitelio y tejido conectivo), por medio de membranas que favorecían el crecimiento de poblaciones celulares del ligamento periodontal, del periostio y de los espacios medulares.
Tras la evidencia de la regeneración conseguida y de la posibilidad de ser mantenida en el tiempo, se considera a la R.T.G. como la técnica regenerativa más predecible.
El artículo repasa los resultados obtenidos con membranas reabsorbibles y no reabsorbibles y describe la técnica quirúrgica, considerando que su empleo debe basarse en un adecuado diagnóstico, siendo imprescindible un riguroso control de placa y de la infección.
Se discuten las variables conocidas que condicionan la R.T.G. y la necesidad de un adecuado programa de mantenimiento para conservar los resultados.
Conclusiones Finales :
Las propiedades asombrosas de regeneración también existen en animales vertebrados. Conocido es el caso de las salamandras, por ejemplo, las cuales son capaces de regenerar patas, ojos, mandíbulas, corazón y riñones, así como el caso de los renacuajos, que al perder su cola son capaces no sólo de regenerarla sino también de reconectarla al sistema nervioso y vascular. Muchos son los tejidos que compartimos los humanos con una cola de renacuajo o una pata de salamandra: huesos, espina vertebral, nervios, músculos, vasos sanguíneos y tejido conectivo.
Siendo los seres humanos metazoarios como las planarias y los anfibios, no es de extrañarnos que compartamos con estos organismos no sólo dichos tejidos, sino también gran cantidad de genes. ¿Por qué entonces somos incapaces de regenerar miembros amputados, o espinas dorsales, o nervios motores, si nuestros cromosomas poseen todas las herramientas necesarias para ejecutar su regeneración?
Actualmente sabemos que la Ciencia ha logrado demostrar como al implantar células totipotenciales en diversos tejidos , estas generan células del mismo tipo del tejido donde se implantan. Ej. Una célula de tipo totipotencial extraída del tejido óseo es capaza de transformarse en una célula hepática e incluso en neurona.
Sin embargo a pesar del desarrollo asombros de técnicas quirúrgicas, no debemos olvidar los principios básicos para lograr el éxito :
1.- Conocimiento profundo del terreno local en que actuamos .
2.- Conocimiento profundo de los principios fisiológicos generales del organismo.
3.- Conocimiento y práctica de la técnica a emplear.
Existen nuevos avances en el campo de la regeneración tisular, como ser las Bioestimulinas descubiertas en Cuba .
Se logra aislar del tejido placentario novedosas sustancias denominadas BIOESTIMULINAS, FACTORES DE CRECIMIENTO CELULAR o CELULOTROFINAS).
Poseen diversas estructuras químicas y su actividad farmacológica consiste en estimular, inhibir o modular las funciones de grupos de células que constituyen los órganos y tejidos del feto durante su vida intrauterina.
Son de naturaleza proteica aproximándose a la naturaleza de los ácidos nucleicos. Generadas en condiciones adversas su función principal es restablecer el equilibrio bioquímico alterado y oponerse a la muerte del tejido. Extraídas y aplicadas al organismo o a estructuras enfermas promueven su recuperación
Igualmente la utilización de Isoterapia Citoplasmática Reactivante, un producto de los avances de la Homotoxicología, permite disponer en la actualidad de direccionadores de la regeneración ósea o gingival, al igual que de cualquier otro órgano. Esta terapia también se conoce como Sarcodeterapia y nos ha proporcionado un alto grado de satisfacción profesional.
OTRAS TECNICAS DE REGENERACION TISULAR DISPONIBLES A LA FECHA
Q. REGENERACION TISULAR MEDIANTE USO DE LASER DE BAJA INTENSIDAD (Dra. María Isela Garrigo Andreu y Dra. Carolina Valiente)
En ambos casos, la aplicación de la radiación láser determina un incremento del proceso curativo en general.
Su acción se basa en la multiplicación celular, la formación de fibras colágenas y elásticas, la regeneración de vasos, la cicatrización de tejido óseo y la reepitelización del tejido dañado. "
Multiplicación celular. Estudios experimentales en cultivo de células describen que cuando se irradia con láser de baja potencia en pequeñas dosis, se estimula la proliferación celular, a partir de la activación de los DNA y la síntesis proteica. Igualmente se ha comprobado un incremento de la enzima succinildehidrogenasa, cuya actividad está íntimamente relacionada con la síntesis proteica.
Sin embargo, se plantea que con altas dosis de energía, ocurre una inhibición de los procesos metabólicos intracelulares y se encuentra reducción en la síntesis de ATP, incremento en la actividad de la enzima ATPasa y pérdida del potencial de membrana, con signos de degeneración celular y lisis citoplasmática, así como dilatación perinuclear.
El mecanismo de cicatrización consta de varios procesos:
FORMACION DE FIBRAS COLAGENAS Y ELASTICAS
Estudios realizados en cultivos de fibroblastos demuestran la gran actividad de estas células cuando son irradiados con láser de baja potencia.
La activación de DNA precolágeno I y III, así como la dilatación de los retículos endoplasmáticos y el aumento en el número de mitocondrias sugieren la gran actividad celular en la síntesis de colágeno, sustancia fundamental para el soporte hístico, que permite la formación acelerada de fibras colágenas y elásticas, lo que logra incluso la regeneración de tendones seccionados.
Esta formación de sustancia colágena en forma guiada y organizada, permite la cicatrización de las heridas rápidamente, y plantea su cicatrización sin escaras hipertróficas o queloides.
FORMACION DE VASOS SANGUINEOS Y REGENERACION NERVIOSA
Por la acción del láser sobre las células del endotelio vascular se incrementa la actividad mitótica y se producen aceleradamente yemas o brotes de los vasos existentes para la neoformación de microvasos.
En cuanto a la regeneración nerviosa, investigaciones realizadas de nervio facial seccionado experimentalmente en ratones y de nervio medial en humanos, señalan resultados exitosos al aplicar láser de baja potencia.
REPARACION DE DEFECTOS OSEOS Y CICATRIZACION DE FRACTURAS
La cicatrización ósea envuelve varios procesos fisiológicos: síntesis de colágeno, mineralización, respuesta vascular y otras.
El incremento en la actividad del DNA fue demostrado en estudios de cultivo de células clonales óseas y se comprobó que el láser de baja potencia estimula la proliferación de células osteoblásticas e incrementa la capacidad reparativa del tejido óseo en vivo.
Para la mineralización del hueso y el cartílago es importante la actividad de la enzima fosfatasa alcalina. Se ha demostrado que en fracturas de fémur irradiadas con láser de baja potencia, la expresión de fosfatasa alcalina se incrementa comparada con un grupo control no irradiado.
En estudios experimentales de fractura de tibia en ratones, y evaluados por radiografía, se encontró aumento de la densidad óptica del hueso en la zona de la fractura, cuando se irradió con láser de baja potencia. Este hallazgo refleja la aceleración en la mineralización del callo óseo cuando se utiliza radiación láser.
Se plantea que este efecto bioestimulativo para la mineralización puede estar dado por la fotobioactivación y secundariamente por la fotoacústica generada por la onda ultrasónica de los lásers de pulso.
Una vez más reiteramos la importancia de la dosificación para lograr el efecto bioestimulante deseado.
Investigaciones con microscopia electrónica realizadas en hueso periodontal de ratones han demostrado que con pequeñas dosis de irradiación se encuentran los osteocitos normales, pero en altas dosis, éstos presentan alteraciones que sugieren procesos degenerativos.
El núcleo presenta una condensación progresiva de cromatina y en algunos casos destrucción total, en el citoplasma se observan cuerpos lisosomales y figuras mielínicas, características de degeneración celular
CONCLUSIONES SOBRE USO DEL LASER EN REGENERACIÓN TISULAR
Se plantea que la acción del láser de baja potencia en la reparación hística se basa en el incremento de la multiplicación celular, la activación en la producción de colágeno y fosfatasa alcalina, la activación del endotelio vascular, aumento de fibras colágenas y elásticas, regeneración de fibras nerviosas y de tejido óseo, incremento en la velocidad de crecimiento de los vasos sanguíneos a partir de los ya existentes y la inducción a partir de las células epiteliales adyacentes a la lesiónde la reepitelización (cuadro general de acción). Como resultado se obtiene la reparación acelerada y completa de los tejidos dañados.
R.-REGENERACION VASCULAR
Se sabe que el flujo sanguíneo no sólo es un parámetro indicativo del aporte de substratos a los órganos de la economía, sino también constituye una señal reguladora del metabolismo.
Los componentes hemodinámicos (estrés por fricción y deformación por presión) actúan sobre el endotelio vascular liberando sustancias bioactivas que afectan al parénquima.
El hígado tiene como propiedad el poder regenerarse.
Durante este proceso aumenta selectivamente la liberación de enzimas de escape y el flujo sanguíneo hepático. El mecanismo de esta liberación es desconocido. El flujo afecta la liberación de enzimas en el hígado normal y en regeneración. lla viscosidad de la sangre cambia la liberación de enzimas de escape y la mecanotransducción es mediada por el endotelio vascular.
En este estudio efectuado por los doctores Díaz A*., Hernández-Muñoz Instituto Fisiología Celular, UNAM. **Instituto Nacional de Cardiología "I. Chávez".México D.F. México. se utilizó el modelo de hígado perfundido por el método de irrigación por perfusión. En el perfusado, por métodos espectrofotométricos, se midió la actividad en condiciones normales y cambiando la viscosidad . se midió la actividad en condiciones normales y cambiando la viscosidad de 5 enzimas de localización citosólica y mitocondrial. Se inhibieron glucoproteínas del glucocálix del endotelio vascular.
Al aumentar el flujo de perfusión se obtuvo un incremento selectivo en la actividad enzimática, siendo mayor durante la regeneración. Al cambiar la viscosidad aumentó la liberación de todas las enzimas. Cuando se utilizaron inhibidores del glucocálix endotelial se inhibió la actividad de la ornitin transcarbamilasa y de las transaminasas.
Conclusion: el flujo regula la liberación de enzimas hepáticas y este efecto es mediado por el endotelio vascular pero es diferente el mecanismo para cada enzima de escape.
Este efecto pudiera estar regulado por el flujo y mediado por el endotelio.
S.- REGENERACION DE MEDULA ESPINAL Y TEJIDO NERVIOSO
REPARACION DE LA MEDULA ESPINAL DAÑADA
Actualmente se ensayan, con cierto éxito, sustancias que inhiben el daño excitotóxico e inmunológico posterior a la lesión medular; el cual abarca un área mucho mayor que la lesión original.
[Scientific American Sep 1999:55-63]
Con mucha frecuencia, señalan los autores, el resultado de un daño grave a la médula espinal es la parálisis total o parcial y la pérdida de la sensibilidad por debajo del nivel de la lesión.
Hace 10 años los médicos no tenían manera de limitar esta discapacidad. Los avances establecidos por el Miami Project sobre regeneracion de médula espinal, muestran otras opciones. Igualmente los avances sobre la materia desarrollados por la Universidad de Zurich oermiten cambiar este concepto tradicional y entregar esperanzas a quienes tienen daño espinal.
A diferencia del tejido del sistema nervioso periférico, el tejido del sistema nervioso central (médula espinal y cerebro) no se autorrepara de manera eficaz.
En 1990 un estudio multicéntrico reveló que la administración de altas dosis de metilprednisolona, dentro de las 8 horas de producida la lesión, permite preservar algo de la función motora y sensitiva.
Las mejorías eran modestas, pero este éxito impulsó la búsqueda de otras terapias similares. En este artículo se explica el modo en que puede utilizarse el creciente conocimiento sobre este tema para ayudar a las personas con lesiones de la médula espinal.
La médula espinal, explican los autores, tiene 2 sistemas principales de neuronas.
Las vías motoras descendentes controlan los músculos lisos de los órganos internos y el músculo estriado, y ayudan a regular la función del sistema nervioso autónomo.
Las vías sensoriales ascendentes transmiten señales recibidas desde las extremidades y los órganos hacia segmentos específicos de la médula y luego hacia el cerebro.
Los cuerpos celulares del tronco medular se ubican en un centro de color gris y forma de mariposa extendido a lo largo de toda la médula espinal.
Las fibras axonales ascendentes y descendentes transcurren por un área circundante conocida como materia blanca.
Ambas regiones contienen también células gliales que ayudan a las neuronas a sobrevivir y trabajar adecuadamente, y que incluyen los astrocitos, la microglía y los oligodendrocitos (productores de mielina).
Cuando una caída, o alguna otra fuerza, fractura o disloca la columna vertebral, los huesos que normalmente encierran y protegen la médula pueden lesionarla, dañando los axones mecánicamente.
En ocasiones, señalan los autores, sólo se lesiona significativamente la materia gris del área involucrada.
Si ese fuera todo el daño, las alteraciones musculares y sensoriales se limitarían a los tejidos que reciben o envían señales a neuronas ubicadas a nivel de la lesión, sin alterar demasiado la función por debajo de ese nivel.
En cambio, si se destruye toda la materia blanca en ese mismo segmento se interrumpen las señales verticales que viajan a y desde las regiones ubicadas por debajo del área dañada.
Desafortunadamente, recalcan, el daño inicial es sólo el comienzo del problema.
En los siguientes minutos, horas o días se desata una segunda ola de daño que agranda la lesión de manera progresiva. En consecuencia, aumenta la extensión del deterioro funcional.
Los axones dañados se convierten en muñones inútiles y sus terminales nerviosas se desintegran.
Donde había neuronas o axones se forma una cavidad llena de líquido y las células gliales proliferan en forma anormal, creando acúmulos denominados cicatrices gliales.
Primero que nada, hay que contener el daño Si fuera necesario revertir todos estos cambios para ayudar a los pacientes el panorama terapéutico sería desalentador, opinan los autores.
Por fortuna, parece que el salvataje de la actividad normal del 10% de los axones posibilita, en ocasiones, que el paciente camine.
Dado el gran daño producido luego de la lesión inicial, es necesario esclarecer cómo ocurre esta destrucción secundaria y cómo bloquear estos procesos.
Pocos minutos después del traumatismo, aparecen pequeñas hemorragias a causa del daño a los vasos sanguíneos, con lo cual se edematiza la médula espinal.
El daño vascular y el edema impiden la llegada normal de nutrientes y de oxígeno a las células, de modo que muchas mueren.
Además, destacan, las células dañadas, los axones y los vasos sanguíneos liberan sustancias químicas tóxicas que impactan sobre las células vecinas intactas.
Una de estas sustancias, el glutamato, dispara un proceso altamente nocivo conocido como excitotoxicidad.
En la médula espinal normal los terminales axonales secretan cantidades minúsculas de glutamato que, al unirse a los receptores de las neuronas blanco, estimula la producción de impulsos nerviosos.
Cuando se produce el daño medular, las células liberan grandes cantidades de glutamato; con ello las células vecinas se sobreexcitan y permiten la entrada masiva de iones, disparando varios procesos destructivos.
Esta excitotoxicidad puede matar también a los oligodendrocitos.
Así se explica por qué la desmielinización afecta también a los axones no lesionados.
La inflamación prolongada, caracterizada por el aflujo de células del sistema inmune, puede exacerbar estos efectos, resaltan los autores.
Aunque en condiciones normales las células inmunitarias no pueden ingresar al sistema nervioso central, el daño de los vasos sanguíneos posibilita su ingreso.
La metilprednisolona, la primera droga que resultó eficaz para limitar el daño medular en humanos, podría actuar en parte reduciendo el edema, la inflamación, la liberación de glutamato y la acumulación de radicales libres.
Los agentes que bloquean selectivamente a los receptores de glutamato de la denominada clase AMPA (abundante en oligodendrocitos y neuronas) parecen ser particularmente eficaces para limitar el tamaño final de la lesión.
Ciertos antagonistas de los receptores AMPA ya fueron utilizados en ensayos preliminares en pacientes con accidente cerebrovascular.
Aunque gran parte de la muerte celular temprana ocurre por necrosis, señalan los autores, en los últimos años se ha reconocido una forma más activa de muerte celular.
Se la ha denominado apoptosis y puede afectar a oligodendrocitos ubicados hasta 4 segmentos más allá del sitio de la lesión. Este descubrimiento también ha abierto las puertas a nuevas terapias protectoras.
Se ha observado que luego de una lesión espinal traumática las ratas tratadas con inhibidores de la apoptosis retienen mayor capacidad ambulatoria que las no tratadas.
En los últimos años se identificaron además varias sustancias, denominadas factores neurotróficos, que también promueven la supervivencia neuronal y glial. Una sustancia relacionada, el gangliósido GM-1, se evalúa actualmente en humanos.
La mejor terapia no sólo debería reducir la extensión de la lesión sino también reparar el daño, sostienen los autores.
Un componente clave de esa estrategia sería la estimulación de la regeneración de los axones dañados; es decir su elongación y reconexión con las células adecuadas.
Las neuronas del sistema nervioso central de los mamíferos adultos suelen ser incapaces de regenerar axones lesionados. Pero esto no se debe a una propiedad intrínseca de las células sino a la influencia de su entorno.
En segundo lugar, se debe inducir la regeneración En la médula espinal hay sustancias, algunas de ellas en la mielina, que inhiben en forma activa la regeneración axonal.
La inyección de anticuerpos que bloquean la acción de estos inhibidores en la médula espinal dañada, en ratas, induce un recrecimiento importante de los axones lesionados, destacan los autores.
Se han descubierto, agregan los autores, otras muchas sustancias inhibidoras, incluyendo algunas producidas por los astrocitos o que se ubican en la matriz extracelular.
Además de abolir la inhibición del recrecimiento axonal, señalan, es necesario aportar sustancias que promuevan activamente ese proceso.
Por ejemplo, la neurotrofina 3 (NT-3) estimula selectivamente el crecimiento de los axones que descienden a la médula espinal desde el cerebro. La producción natural de esta sustancia es limitada, pero la elevación artificial de sus niveles permite, en animales, estimular la regeneración axonal.
Una vez que los axones comienzan a crecer deben ser guiados hacia las células blanco, a las cuales se dirigían originalmente. En los últimos años se han descubierto varias de las sustancias que guían a los axones durante el desarrollo embrionario. Algunas, como las netrinas, son liberadas o secretadas por neuronas o células gliales.
Hay que establecer las conexiones adecuadas. Algunas investigaciones, comentan los autores, sugieren que puede ayudarse a la regeneración si se suministra una selección de netrinas y componentes de la matriz extracelular. Una estrategia diferente es la de llenar la brecha creada en la médula por la lesión, generando un conducto por el cual puedan transcurrir los axones.
Por ejemplo, se han implantado en animales tubos llenos de células de Schwann, lo que permitió cierto crecimiento axonal dentro del tubo. También se han diseñado puentes con fibroblastos alterados genéticamente para producir NT-3; éstos han permitido un recrecimiento parcial de los axones.
Reemplazo de las células perdidas . Otros esquemas de trasplante incluyen la implantación de células halladas normalmente en el sistema nervioso central.
El trasplante de tejido nervioso fetal, destacan, ha producido varios resultados excitantes en los animales tratados poco tiempo después del trauma.
Este tejido inmaduro puede dar lugar a nuevas neuronas y estimular a las ya existentes a enviar axones regenerados hacia el tejido implantado. Sin embargo, la aplicación de tejido fetal en humanos estará limitada por razones éticas y por la falta de donantes.
Una de las alternativas consiste en trasplantar células troncales o precursoras localizadas en el sistema nerviso central adulto, capaces de dar origen a neuronas y células gliales.
Estrategias a seguir con células troncales .Los médicos, postulan los autores, podrían extraer células troncales neurales del cerebro o la médula espinal del paciente, expandirlas en el laboratorio e introducirlas en la médula de la misma persona sin riesgo de rechazo del implante.
Esta estrategia, incluso, podría reemplazarse por la terapia génica.
La introducción de genes dentro de las células sobrevivientes de la médula espinal les permitiría producir y liberar proteínas capaces de inducir la proliferación de células troncales, aumentar la diferenciación y la supervivencia, y promover la regeneración axonal, el direccionamiento de los axones y su remielinización.
Hasta tanto se desarrollen estas técnicas, los pacientes pueden beneficiarse con el uso de fármacos que restauran la conducción de señales en los axones que han perdido su función al desmielinizarse.
Se están realizando ensayos clínicos para evaluar la capacidad de la 4-aminopiridina de compensar la pérdida de mielina. Esta droga, explican, bloquea temporariamente los canales de potasio de la membrana axonal.
De esta manera los axones pueden transmitir señales eléctricas más allá del área de desmielinización.
Otra terapia a considerar es el uso de factores neurotróficos como el NT-3, actualmente evaluado en pacientes con daño en la médula espinal, aunque no para restaurar la mielinización sino para estimular la función intestinal por su acción sobre los nervios del sistema digestivo.
Esperanza en los próximos años . No se puede vaticinar el momento en que estas nuevas ideas se transformarán en tratamientos concretos.
No obstante, destacan los autores, resulta alentador que estén en marcha 2 ensayos en humanos y que otros vayan a comenzar en los próximos años.
La limitación del daño será más fácil que su reversión. Por ello se espera que los tratamientos atenuantes del daño secundario sean los primeros en realizarse.
De las estrategias de reparación, es probable que la remielinización sea la tarea más fácil. No puede adivinarse cuándo estarán disponibles las terapias reconstructivas, pero puede anticiparse un progreso continuo hacia ese objetivo.
Nuestra esperanza es mantener activos los sistemas, hasta que la ciencia entregue los recursos terapéuticos indispensables para modificar el daño tisular.
Podemos decir actualmente, que los conceptos y recursos de Regeneración Tisular están avanzando a tal rapidez en el mundo científico actual, que todo lo que conocemos a la fecha, quedará obsoleto en el corto plazo.
Dr.Horacio Kinast Feliú
Centro Nacional de Medicina Biológica
Santiago de Chile. Agosto 2001
Bibliografía utilizada en material sobre oseodistracción guiada:
MC.CARTHY, J.G., Schreiber, J., Karp, N. et al. Lengthening the human mandible by gradual distraction. Plast reconstr Surg 1992; 89:1-8
Fischer, E., Staffenberg, D. et al. Histopathologic and biochemical changes in the muscles affected by distraction osteogenesis of the mandible. Plast Reconstr Surg 1997; 99:366-70
Harper, R.P., Bell, W.H., Hinton, R.J et al. Reactive Changes in the temporamandibular joint after mandibular midline osteodistraction. Brit J Oral Maxillofac Surg 1997; 35:20-5
McCarthy, J.G. The role of distraction osteogenesis in the reconstruction of the mandible in the unilateral craniofacial microsomia. Clin Plast Surg 1994; 21:625-31
Altuna, G., Walker, D., Freeman, E. Rapid orthopedic lengthening of the mandible in primates by sagittal split osteotomy and sistraction osteogenesis: A pilot study. Int J Adult Orthod 1995; 10: 59-64
Yamamoto, H., Sawaki, Y., et al. Maxillary advancement by distraction osteogenesis using osseointegrated implants. J CranioMaxilofac Surg 1997; 25: 186-91
Molina, F., Ortiz-Monasterio, F. Mandibular enlongation and remodeling by distraction: A farewell to major osteotomies. Plast Reconst Surg 1995; 96: 825-40
Guerrero, C., Bell, W., et al. Distraccion osteogenica mandibular intraoral. Odontol dia 1995; 11: 116-32
Mcormick, S.U., McCarthy, J.G., et al. Effect of , mandibular distraction on the tempomandibular joint: Part 1. Canine study. J Craniofac Surg 1995; 6: 358-63
McCormick, S.U., McCarthy, J.G., et al. Effect of mandibular distraction on the tempomandibular joint: Part 2. Clinical study. J Craniofac Surg 1995; 6: 364-67
Bell, W.H., Harper, R.P., et al. Distraction Osteogenesis to widen the mandible. Brit J Oral Maxillofac Surg 1997; 35:11-19
Michieli, S., Miotti, B. Lengthening of mandibular body by gradual surgical orthodontic distraction. J Oral Surg 1977 35:
Ilizarov, G. Transosseus osteosynthesis. Theoretical and clinical aspects of the regeneration and growth of tissue. Berlin, Springer-Verlag, 1992.
Schwartsman, V., Achawartsman, R. Corticotomy. Clin Orthop Rel Res 1992; 280;37-47
Polley, J.W., Figueroa, A.A. Piggiback osteotomies in craniomaxillofacial surgery. J CraniofacSurg 1995; 6: 199-210
Polley, J.W., Figueroa, A.A. Rigid external distraction: its application in cleft maxillary deformities. Plast Reconstr Surg 1998; 102:1360-1372
Polley, J.W., Figueroa, A.A. Management of severe maxillary deficiency in childhood and adolescence through distraction osteogenesis with an external, adjustable, rigid distraction device. J Craniofac Surg 1997; 8: 181-85
Figueroa, A.A., Polley, J. W. Managemento of severe cleft maxillary deficiency with distraction osteogenesis: Procedures and results.Am J Orthod Dentofac Orthoped 1999; 115: 1-12
Mehrara, B., Longaker, M., McCarthy, J.G., et al. Distraction osteogenesis. Biology. En: Sachdeva, R. Orthodontics for the next millenium. Glendora, Ormco, 1997
Mherara, B., Longaker, M., McCarthy, J.G., et al. Distraction Osteogenesis. Clinical experience. En: Sachdeva, R. Orthodontics for the next millenium. Glendora, Ormco, 1997
. Liou, E., Huang, S. Rapid canine retraction though distraction of the periodontal ligament. Am J Orthod Dentofac Orthoped 1998; 114: 372-382
Losken, H.W., Patterson, G.T., et al. Planning madibular distraction: Prelimonary report. Cleft Palate Craniofac J 1995; 32: 71-6
Klein, C., Howaldt, H.P. Correction of mandibular hypoplasya by means of bidirectional callous distraction. J Craniofac Surg 1996; 7: 258-66
Shvyrkov, M.B., Sumarokov, D.D., et al. Osteoplasty of the mandible by local tissues. J Craniomaxillofac Surg 1995; 23: 377-81
Ilizarov´s method. W.w.w.info ilizarov.com
Bibliografía sobre electrolitos
- Delpón E, Valenzuela C, Pérez 0, Tamargo J, Electrophysiological effects of the combination of imipramine and desipramine in guinea pig papillary muscles, J. Cardiovasc. Pharmacol. 1993; 21: 13-20.
- Pérez-Vizcaíno F, Carrón R, Delpón E. Duarte J, Tamargo J, Effects of (s)-nafenodone on 45Ca2+ fluxes and contractions in rat isolated vascular smooth muscle. Eur. J. Pharmacol.. 1993; 232: 105-111.
- Delgado C, Lorente p, Hemzel D, Tamargo J, Effects of propafenone on calcium current in guinea-pig ventricular myocytes. Br. J. Pharmacol. 1993; 108: 721-727.
- Valenzuela C, pérez 0, Casis 0, Duarte J, pérez-Vizcaíno F, Delpón E, Tamargo J. Effects of lisinopril on electromechanical properties and membrane currents in guinea-pig cardiac preparations. Br. J. Pharmacol. 1993; 109: 873-879.
- Duarte J, pérez-Vizcaíno F, Utrilla p, Jimenez J, Tamargo J, Zarzuelo A. V asodilatory effects of flavonoids in rat aortic smooth muscle, structure-activity relationships, Gen. Pharmac. 1993; 24: 857-862.
- Duarte J, pérez 0, Zarzuelo A, Jimenez J, pérez-Vizcaíno F, Tamargo J. Effects of oleuropeoside in isolated guinea-pig atria. Planta Medica 1993; 59: 318-322.
- Tamargo J. Propafenone slows conduction and produces a nonuniform recovery of excitability between Purkinje and ventricular muscle fibers. J. Cardiovasc. Pharmacol. 1993; 22: 203-207.
- Duarte J, pérez-Vizcaíno F, Zarzuelo A. Jiménez J, Tamargo J. Vasodilator effects of quercetin on contractile responses in isolated rat aorta, Eur. J. Pharmacol. 1993; 239: 1-7.
- Pérez-Vizcaíno F, Casis 0, Rodríguez R, Gómez LA, García Rafanell J, Tamargo J. Effects of the novel potassium channel opener, UR-8225, on contractile responses in rat isolated smooth muscle. Br. J. Pharmacol. 1993; 110: 1165-1171.
- Pérez-Vizcaíno F, Tamargo J, Hof RP, Rüegg UT. Vascular selectivity of seven prototype calcium antagonists: A study at the single cell level. J. Cardiovasc. Pharmacol. 1993; 22: 768-775.
- Tamargo J, Delpón E, Valenzuela C. Treatment of left ventricular hypertrophy in hypertensive patients. Eur. Heart J. 1993; 14 (Suppl J): 102-106.
- Duarte J, pérez-Vizcaíno F, Zarzuelo A, Jimenez J, Tamargo J. Aminophylline preferentially inhibits chloroethylclonidine-insensitive a-adrenoceptor-mediated contractions in rat aorta. Gen. Pharmac. 1993; 24: 1359-1364.
- Perez O, Valenzuela C, Delpón E, Tamargo J. Class I and III antiarrhythmic actions of prazosin in guinea-pig papillary muscles. Br. J. Pharmacol. 1994; 111: 717-722.
- Valenzuela C, Sanchez-Chapula J, Delpón E, Elizalde A, perez O, Tamargo J, Imipramine blocks rapidly activating and delays slowly activating K+ current activation in guinea pig ventricular myocytes, Circ. Res. 1994; 74: 687-699.
- Valenzuela C, Bennett PB. Gating of cardiac Na+ channels in excised membrane patches after modification bya-chymotrypsin. Biophys. J. 1994; 67. 161-171.
- Perez-Cao A, Gil-Loyzaga P, Merchan perez A, Tamargo J. Effects of oxodipine and nitrendipine on the size ofexperimental myocardial infarct in the rat. Pharmacology and Toxicology 1994; 74: 321-329.
- Duarte J, perez-Vizcaíno F, Zarzuelo A, Jimenez J, Tamargo J. Inhibitory effects of quercetin and staurosporine on phasic contractions in rat vascular smooth muscle, Eur. J. Pharmacol. 1994; 262: 149-156.
- Valenzuela C, perez O, Delpón E, Tamargo J. Effects of lisinopril on cardiac contractility and ionic currents. Gen. Pharmac. 1994; 25: 825-832.
- Perez-Vizcaíno F, Fernandez del Pozo B, Zaragozá F, Tamargo J. V oltage- and time-dependent inhibitory effects on rat aortic and porcine coronary artery contraction induced by propafenone and quinidine. Br. J. Pharmacol. 1994; 113: 1281-1288.
- Delpón E, Valenzuela C, perez O, Casis O, Tamargo J. Propafenone preferentially blocks the rapidly activating component of delayed rectifier K+ current in guinea-pig ventricular myocytes. Voltage-independent and time-dependent block of the slowly activating component. Circ. Res. 1995; 76: 223-235.
- Perez-Vizcaíno F, Cooper AC, Corder R, Fournier A, Warner TD. Rapid degradation of ET- 1 by an enzyme released by the rat isolated perfused mesentery, Br. J. Pharmacol. 1995; 114: 867-871.
- Parra L, perez-Vizcaíno F, Alsasua A, Martín I, Tamargo J u- ando -Opioid receptor-mediated contractile effects on rat aortic vascular smooth muscle. Eur. J. Pharmacol. 1995; 277. 99-105,
- Villamor E, perez-Vizcaíno F, Ruiz T, Leza JC, Moro M, Tamargo J, Group B Streptococcus and E. coli LPS-induced NO-dependent hyporesponsiveness to noradrenaline in isolated intrapulmonary arteries of neonatal piglets, Br. J. Pharmacol. 1995. 115: 261-266.
- Perez O, Gay p, Franqueza L , Carrón R, Valenzuela C, Delpón E, Tamargo J. Effects of the two enantiomers, S-16257-2 and S-16260-2, of a new bradycardic agent on guinea pig isolated cardiac preparations. Br. J. Pharmacol. 1995; 115: 787-794.
- Bennett PB, Valenzuela C, Chen L-Q, Kallen R, On the molecular nature of the lidocaine receptor of cardiac Na+ channels: Modification of block by alterations in the a-subunit III-IV interdomain. Circ. Res. 1995; 77. 584-592.
- Perez O, Gay P, Franqueza L, Carrón R, Valenzuela C, Delpón E, Tamargo J. Electromechanical effects of zatebradine on isolated guinea pig cardiac preparations. J. Cardiovasc. Pharmacol. 1995; 26: 46-54.
- Tamargo J, perez O, Delpón E, García-Rafanell J, Cardiovascular effects of UR-8225, a novel potassium channel opener: comparison with levcromakalim. J. Cardiovasc. Pharmacol. 1995; 26: 295-305.
- Valenzuela C, Delpón E, Tamkum MM, Tamargo J, Snyders DJ Stereoselective block of a human cardiac potassium channel (Kv 1,5) by bupivacaine enantiomers. Biophys. J. 1995; 69. 418-427.
- Tamargo J, López-Sendón JL. Relevance of the pharmacokinetic profile in the treatment of angina pectoris. the need for 24 hour control. Eur. Heart J. 1995; 18 (suppl E): 57-61.
- Valenzuela C, Snyders DJ, Bennett p, Tamargo J, Hondeghem LM, Stereoselective block of cardiac sodium channels by bupivacaine in guinea pig ventricular myocytes. Circulation 1995; 92: 3014-3024.
- Duarte J, perez-Vizcaíno F, Torres AI, Zarzuelo A, Jimenez J, Tamargo J, V asodilator effects of visnagin in isolated rat vascular smooth mucIc. Eur. J. Pharmacol. 1995; 286: 115-122.
- Navarro-Cid J, Maeso R, perez-Vizcaíno F, Cachofeiro V, Ruilope LM, Tamargo J, Lahera V. Effects of losartan on blood pressure, metabolic alterations, and vascular reactivity in the fructose-induced hypertensive rat, Hypertension 1995; 26: 1074-1078.
- Fernandez del Pozo B, perez-Vizcaíno F, Villamor E, Zaragozá F, Tamargo J. Stereoselective effects of the enantiomers, quinidine and quinine, on depolarization- and agonist-mediated responses in rat isolated aorta, Br. J. Pharmacol. 1996; 117. 105-110.
- Delpón E, Valenzuela C, perez 0, Franqueza L, Gay p, Snyders D, Tamargo J. Mechanisms of block of a human cloned potassium channel by the enantiomers of a new bradycardic agent: S- 16257-2 and S- 16260-2, Br. J. Pharmacol. 1996; 117. 1293-1301.
- Perez-Vizcaíno F, Villamor E, Fernandez del Pozo B, Moro M, Tamargo J, Lack of endotoxin-induced hyporesponsiveness to U46619 in isolated neonatal porcine pulmonary but not mesenteric arteries, J. Vase. Res. 1996; 33: 249-257.
- Villamor E, perez-Vizcaíno F,RuizT, Tamargo J, Moro M. In vitro effects of magnesium sulfate in isolated intrapulmonary and mesenteric arteries of piglets. Pediatric Res. 1996; 39: 1107-1112.
- Navarro-Cid J, Maeso R, perez-Vizcaíno F, Casal MC, Cachofeiro V, Ruilope LM, Tamargo J, Lahera V. Effects of antihypertensive drugs on blood pressure and metabolic alterations in the fructose-induced hypertensive rat, Am. J. Hypertens. 1996; 9. 669-674.
- Valenzuela C, Delpón E., Franqueza L, Gay p, perez 0, Tamargo J, Snyders DJ, Class III antiarrhythmic effects of zatebradine. Time-, state-, use-, and voltage-dependent block of hKv 1.5 channels, Circulation 1996; 94: 562-570.
- Villamor E, perez-Vizcaíno F, Tamargo J, Moro M. Effects of group B streptococcus on the responses to U46619, endothelin- 1, and noradrenaline in isolated pulmonary and mesenteric arteries of piglets. Pediatric Res. 1996; 40: 827-833.
- Perez-Vizcaíno F, Villamor E, Moro M, Tamargo J Pulmonary versus systemic effects of vasodilator drugs, An in vitro study in isolated intrapulmonary and mesenteric arteries of neonatal piglets. Eur. J. Pharmacol. 1996; 314: 91-98.
- Tamargo J, perez 0, Delpón E, perez-Vizcaíno F, García-Rafanell J., Gómez J, Cavalcanti F. Pharmacology of UR-8225, a new potassium channel opener, Cardiovasc, Drug Revs. 1996, 14: 256-271.
- Perez 0, Valenzuela C, Delpón E, Tamargo J. Electrophysiological effects of CI-980, a tubulin binding agent, on guinea pig papillary muscles, Br. J. Pharmacol. 1997. 120: 187-192.
- Valenzuela C, Delpón E, Franqueza L, Gay P, Vicente J, Tamargo J. Comparative effects of nonsedating Hl receptor antagonists, ebastine and terfenadine on human Kvl.5 channels. Eur. J. Pharmacol. 1997. 326: 257-263.
- Villamor E, Ruiz T, perez-Vizcaíno F, Tamargo J, Moro M. Endothelium-derived nitric oxide-dependent response to hypoxia in piglet intrapulmonary arteries. Biology Neonate. 1997. 72: 62-70.
- Valenzuela C, Delpón E, Franqueza L, Gay p, perez 0, Tamargo J. Effects of ropivacaine on a potassium channel (hKv I .5) cloned from human ventricle. Anesthesiology. 1997. 86: 718-728.
- Pérez-V izcaíno F, V illarmor E, Duarte J, Tamargo J. Inhibition of the relaxant response to the nitric oxide/cyclic GMP pathway to the thromboxane A2, analogue 46619 and endothelin- 1 in pigletpulmonary arteries. Br. J. Pharmacol. 1997. 121: 1323-1333.
- Duarte J, Vallejo I, pérez-Vizcaíno F, Jiménez J, Zarzuelo A, Tamargo J, Effects of visnadine on rat isolated vascular smooth muscles. Planta Medica. 1997. 63: 233-236.
- Delpón E, Valenzuela C, Gay p, Franqueza L, Snyders D, Tamargo J. Block of human cardiac Kvl.5 channels by loratadine. Voltage-, time- and use-dependent block at concentrations above therapeutic plasma levels. Cardiovasc. Res. 1997. 35: 341-350.
- Fernandez del Pozo B, pérez-Vizcaíno F, Fernandez C, Zaragoza F, Tamargo J. Effects of several class I antiarrhythmic drugs on isolated rat aortic vascular smooth muscle. Gen. Pharmacol. 1997. 29: 539-543.
- Caballero R, Delpón E, Valenzuela C, Longobardo M, Franqueza L, Tamargo J, Effect of descarboethoxyloratadine, the major metabolite of loratadine, on the human cardiac potassium channel Kv 1.5, Br. J. Pharmacol. 1997. 122: 796-798.
- Duarte J, Ocete M, pérez-Vizcaíno F, Zarzuelo A, Tamargo J. Effect of tyrosine kinase and tyrosine phosphatase inhibitors on aortic contraction and induction of nitric oxide synthase. Eur. J. Pharmacol. 1997. 338: 25-33.
- Franqueza L, Longobardo M, Vicente J, Delpón E, Tamkun M, Tamargo J, Snyders D, V alenzuela C. Molecular determinants of stereoselective bupivacaine block of hKv 1.5 channels. Circ. Res. 1997.81: 1053-1064.
Bibliografía general sobre magnesio en clinica :
Banco Documentación Centro Nacional De Medicina Biológica Instituto Clínico Kinast
1. Seelig, M.S. Magnesium (and trace substance) deficiencies in the pathogenesis of cancer. Biol. Tr. Elem. Res. 1979; 1:273-297.
2. Wacker, W.E.C. Magnesium and Man. Harvard Univ. Press, Cambridge, MA, 1980.
3. Aikawa, J.K. Magnesium: Its Biologic Significance. CRC Press, Boca Raton, FL, 1981.
4. Heaton, F.W., Rayssiguier, Y. Magnesium deficiency and membrane properties. in Magnesium in Cellular Processes and Medicine. Altura, B.M., Durlach, J. and Seelig, M.S. (from 4th Intl Mg Sympos, Blacksburg, W. Virginia, 1985), S. Karger AG, Basel, Switzerland, 1987; 121-130.
5. Heaton, F.W., Tongyai, S., Rayssiguier, Y. Membrane function in magnesium deficiency. in Magnesium in Health and Disease. (from 5th Intl Mg Sympos, Kyoto, Japan, 1988) Itokawa, Y. and Durlach J., Eds., John Libbey Press, London, Paris, 1989; 27-33.
6. Guenther, T., Averdunk, R. Membranes of magnesium deficiency induced neoplastic cells. Magnesium Bull. 1985; 7:146-151.
7. Walker, G.M. Magnesium as the fundamental regulator of the cell cycle. Magnesium 1982; 2:1-16.
8. Walker, G.M. Magnesium and cell cycle control: an update. Magnesium 1986; 5:9-23.
9. Duffus, J.H., Walker, G.M. Magnesium in mitosis and the cell cycle. In Magnesium in Cellular Processes and Medicine, (from 4th Intl Mg Sympos, Blacksburg, W. Virginia, 1985 Eds B.M. Altura, J. Durlach, M.S. Seelig, Publ. S. Karger AG, Basel, Switzerland, 1987; 131-141.
10. Hass, G.M., Laing, G.H., Galt, R.M., McCreary, P.A. Recent advances: immunopathology of magnesium deficiency in rats: induction of tumors; incidence, transmission and prevention of lymphoma-leukemia. Magnesium Bull. 1981; 3:217-228.
11. Hass, G.M., Laing, G.H., Galt, R.M., McCreary, P.A. Role of magnesium deficiency in immunity to neoplasia in the rat. Magnesium Bull. 1981; 3:5-11.
12. Hass, G.M., McCreary, P.A., Laing, G.H., Galt, R.M. Lymphoproliferative and immumunologic aspects of magnesium deficiency. In Magnesium in Health and Disease (from 2nd Intl Mg Sympos, Montreal, Canada, 1976), b Eds. M. Cantin, M.S. Seelig, Publ. Spectrum Press, NY, 1980, pp 185-200.
13. Collery, P., Anghileri, L.J., Coudoux, P., Durlach, J. (Magnesium and cancer: Clinical data.) Magnesium Bull. 1981; 3:11-20.
14. Bazikian, K.L. The significance of magnesium salts in oncology. Proc of First Intl Mg Sympos, Vittel, France, Ed. J. Durlach (private printer) 1971; 593-606.
15. Aleksandrowicz, J. Natural environment and health. in Protection of Man's Natural Environment Polish Sci. Publ. 1973; 518-528.
16. Aleksandrowicz, J., Blicharski, J., Dzigowska, A., Lisiewicz, J. Leuko- and oncogenesis in the light of studies on metabolism of magnesium and its turnover in biocenosis. Acta Med. Pol. 1970; 11:289-302. (abstr: Blood 1971; 37:245)
17. Aleksandrowicz, J. (Mycotoxins, bioelements, and perspectives in prophylaxis in the ecology of leukemia). Rev. Esp. Encologia 1975; 22:311-333.
18. Aleksandrowicz,J., Skotnicki, A.B., (transl by E. Nowak) Leukemia Ecology. Ecological Prophylaxis of Leukemia. (Avail from U.S. Dept. Commerce, Natl. Techn. Inform. Serv. Springfield VA 22161) 1982.
19. Hopps, H.C. What causes senescence? In Aging and the Geochemical Environment, Report of Panel, Natl. Res. Council, N.A.S., Natl. Acad. Press, Washington D.C. 1981; 42-71.
20. Hopps, H.C. How might geochemical factors affect senescence and age-associated pathology? In Aging and the Geochemical Environment. Report of Panel, Natl. Res. Council, N.A.S., Natl. Acad. Press, Washington D.C. 1981; 118-126.
21. Jasmin, G. (Lymphedema, hyperplasia, tumefaction of lymphatic tissue of the rat kept on a magnesium deficient diet). Rev. Can. Biol. 1963; 22:383-390.
22. Bois, P. Tumour of the thymus in magnesium-deficient rat. Nature 1964; 204:1316.
23. Bois, P. Peripheral vasodilatation and thymic tumors in magnesium deficient rats. In Endocrine Aspects of Disease Processes. Ed. G. Jasmin, Publ. W.H. Greene Inc, St, Louis, Missouri, USA 1968; 337-355.
24. Bois, P., Sandborn, E.B., Messier, P.E. A study of thymic lymphosarcoma developing in magnesium-deficient rats. Cancer Res. 1976; 29:763-775.
25. McCreary, P.A., Battifora, H.A., Hahneman, B.M., Laing, G.H., Hass, G.M. Leukocytosis, bone marrow hyperplasia and leukemia in chronic magnesium deficiency in the rat. Blood 1967; 29:683-690.
26. Battifora, H.A., McCreary, P.A., Hahneman, B.M., Laing, G.H. Chronic magnesium deficiency in the rat. Studies of chronic myelogenous leukemia. Arch. Path. 1968; 122:610-620.
27. Battifora, H.A., McCreary, P.A., Laing, G.H., Hass, G.M. Chronic granulocytic leukemia and malignant lymphoma in magnesium deficient rats. Am. J. Path. 1969; 55:11a.
28. Battifora, H. Effects of magnesium deficiency on blood cells. Clinical and experimental data. In Proc First Intl Mg Sympos, Vittel, France Ed. J. Durlach (private printer) 1971:501-516.
29. McCreary, P.A., Laing, G.H., Hass, G.M. Susceptibility of normal and magnesium deficient rats to weekly subtumorigenic doses of live lymphoma cells. Am. J. Path. 1973; 7:89.
30. Hunt, B.J., Belanger, L.F. Localized, multiform, sub-periosteal hyperplasia and generalized osteomyelosclerosis in magnesium-deficient rats. Calcif. Tiss. Res. 1972; 9:17-27.
31. Belanger, L.F. Medullary bone and periosteal tumour formation in magnesium deficient rats. In Proc First Intl Mg Sympos, 1971, Vittel, France Ed. J. Durlach (private printer) 1973; 2:425-430.
32. Belanger, L.F., Hunt, B.J., Narbaitz, R. Alkaline phosphatase in hyperplastic bone. Lesions of rats fed a magnesium deficient diet. In Histochemistry and Cytochemistry, Eds T. Takeuchi, K. Ogawa, S. Fujita Publ. Nakashani, Kyoto, Japan 1972; 313-314.
33. Bogoroch, R., Belanger, L.F. Skeletal effects of magnesium deficiency in normal, ovariectomized, and estrogen-treated rats. Anat. Rec. 1975; 183:437-448.
34. Hopps, H.C. Geochemical Environment and Cancer. Geochemistry and the environment. III Distribution of trace elements related to the occurrence of certain cancers, cardiovascular diseases, and urolithiasis. Proc. Workshop, Captiva Island, FL, 1974. Natl. Res. Council, N.A.S. 1977.
35. Sauer, H.I. The definition and demographic characterization of an increased longevity area in the United States. In Aging and the Geochemical Environment. Natl. Res. Council, N.A.S., Natl. Acad. Press, Washington, D.C. 1981; 10-17.
36. Schroeder, H.A. Relations between hardness of water and death rates from certain chronic and degenerative disease in the United States. J. Chron. Dis. 1960; 12:586-591.
37. Anderson, T.W., Neri, L., Schreiber, G.B., Talbot, F., Zdrowjewski, A. Ischemic heart disease, water hardness and myocardial magnesium. Can. Med. Assoc. J. 1975; 113:199-203.
38. Marier, J.R. Cardioprotective contribution of hard water to magnesium intake. Rev. Can. Biol. 1978; 37:115-125.
39. Seelig, M.S. The requirement of magnesium by the normal adult. Am. J. Clin. Nutr. 1964; 14:342-390.
40. Seelig, M.S. Magnesium Deficiency in the Pathogenesis of Disease. Early Roots of Cardiovascular, Skeletal, and Renal Abnormalities. Ed. L.V. Avioli, Publ. Plenum Med. Book Co., New York, N.Y., 1980.
41. U.S. Dept. Agric. Nationwide Food Consumption Survey: Food and nutrient intakes of individuals in 1 day in the U.S.A., 1977-1978, 1980.
42. Pao EM, Mickle SJ: Problem Nutrients in the United States. Food Technol. 35:58-69, y1981.
43. Morgan, K.J., Stampley, G.L., Zabik, M.E., Fischer, : Magnesium and calcium dietary intakes of the U.S. population. J. Am. Coll. Nutr. 1985; 4:195-206.
44. Morgan, K.J., Stampley, G.L. Dietary intake levels and food sources of magnesium and calcium for selected segments of the US population. Magnesium 1988; 7:225-233.
45. Seelig, M.S. Human requirements of magnesium; factors that increase needs. In Proc. 1st Intl Mg Sympos, Vittel, France, Ed. J. Durlach; (private printer) 1971; 10-28.
46. Seelig, M.S., Heggtveit, H.A. Magnesium interrelationships in ischemic heart disease. Am. J. Clin. Nutr. 1974; 27:59-79.
47. Seelig, M.S. Magnesium requirements in human nutrition. (from 3rd Intl. Mg Sympos., 1981, Baden-Baden, Germany) Magnesium Bull.1981; 3(1a):26-47.
48. Seelig, M.S. Nutritional status and requirements of magnesium, with consideration of individual differences and prevention of cardiovascular disease. (from 2nd Europ. Congr. on Mg, Stockholm, Sweden, 1986), Magnesium Bull. 1986; 8:170-185.
49. Seelig, M.S. Cardiovascular consequences of magnesium deficiency and loss: pathogenesis, prevalence and manifestations - magnesium and chloride loss in refractory potassium repletion. Am. J. Cardiol. 1989; 63:4G-21G.
50. Altura, B.M., Altura, B.T. New perspectives on the role of magnesium in the pathophysiology of the cardiovascular system. Clinical aspects. Magnesium 1985; 4:226-244.
51. Anderson, T.W., LeRiche, W.H. Sudden death from ischemic heart disease in Ontario and its correlation with water hardness and other factors. Can. Med. Assoc. J. 1971; 105:155-160.
52. Anderson, T.W., Leriche, W.H., Hewitt, D., Neri, L.C.: Magnesium, water hardness, and heart disease. In Magnesium in Health and Disease, (from 2nd Intl. Mg Sympos., Montreal, Canada, 1976), Eds., M. Cantin, M.S. Seelig, Publ. Spectrum Press, NY, 1980; 565-571.
53. Neri, L.C., Johansen, H.L., Hewitt, D., Marier, J., Langner, N. Magnesium and certain other elements and cardiovascular disease. Sci. Tot. Environm. 1985; 42:49-75.
54. Karppannen, H. Epidemiologic evidence for considering magnesium deficiency as a risk factor for cardiovascular diseases. Magnesium Bull. 1990; 12:80-86.
55. Burnet, F.M. An immunologic approach to aging. Lancet 1970; 2:358-370.
56. Greenberg, L.J., Yunic,E.Y. Genetic control of autoimmune disease and immune responsiveness and the relationship to aging. Birth Defects. Orig Article Ser 1978; 14:249-260.
57. Makinodan, Y., Kay, M.M.B. Age influence on the immune system. Adv. Immunol. 1980; 29:287-330.
58. Haury, V.G. Variations in serum magnesium in health and disease: A review. J. Lab. Clin. Med. 1942; 27:1361-1375.
59. Delbet, P. Presse Med. 1928; 36:1473. (cited by Haury #58)
60. Delbet, P., Robinet, L. Terrains magnesiens et cancer. Bull. Acad. Med. Paris 1932; 111:415. (cited by Haury #58)
61. Bablet, J., Bader, H. Magnesium and cancer in Indochina. Bull. Assoc. Franc.l'Etude de Cancer 1932; 21:570. (cited by Haury #58)
62. Schrupf-Peirron, P. (Causes of rarity of cancer in Egypt). Bull. Acad. Med. Paris 1931; 105:818, 106:235. (cited by Haury, #58)
63. Marchi, C. Carenza di cloruro di magnesio e maggior frequenza di canril not a preventiva. Seritta Biol. 1930, 4:295. (cited by Haury, #58)
64. Heinemann, H. Hippokrates 1953; 24:744. (cited by Bazikian, #14)
65. Neiper, H.A. Med. Welt 1953; 154:272, 1282. (cited by #14)
66. Akemtsev, V. Pochvovedie 1957; 7:91, 1957 (cited by Bazikian, #14)
67. Akemtsev, V., Milin, Z., Smolianionov, J. Moskva 1966; 45:1966. (cited by Bazikian, #14)
68. Balasanian, S. Geokhimia 1959; 3:226, 1959. (cited by Bazikian #14)
69. Miron, W., Sobaniec-Lotowska, M., Sulkowski, S. [Malignant neoplasms in autopsy specimens and the magnesium level in the soil of the communities of Grodek and Tykocin.] Wiad. Lek. 1989; 42:1033-1074.
70. Armstrong, R.W. Is there a particular kind of soil or geologic environment that predisposes to cancer? Ann. N.Y. Acad. Sci. 1972; 199:239-248.
71. World Health Organization Report: Prevention of cancer Tech Rep Ser 276, 1964) & Intl Agency on Cancer, Lyons 1977 (cited by Aleksandrowicz, #18)
72. Mason, T.J., MacKay, F.W., Blot, W.J., Fraumeni, J.F. Jr. Atlas of Cancer Mortality for U.S. Counties: 1950-1969. 1975; DHEW Publ #NIH 75-780.
73. Feder, G.L., Hopps, H.C. Variations in drinking water quality and the possible effects on human health. Tr. Subst. Envirnm. Hlth. 1981; 15:96-103.
74. Kashiwa, H.K., Hungerford, G.F. Blood leucocyte response in rats fed a magnesium deficient diet. Proc. Soc. Exp. Biol. Med. 1958; 99:441-443.
75. Hungerford, G..F, Karson, E.F. The eosinophilia of magnesium deficiency. Blood 1960; 16:1642-1650.
76. Guenther, T., Vormann, J., Hoellrieg, V., Disch, G., Classen, H.G. Role of lipid peroxidation and vitamin E in magnesium deficiency. J. Nutr. Biochem. 1993; (in press)
77. Belanger, L.F., Medullary bone and periosteal tumour formation in magnesium deficient rats. in Proc. First Intl. Mg Sympos. Vittel, France 1971 Ed. J.Durlach, (private printer) 1973; 2:425-430.
78. Belanger, L.F., Hunt, B.J., Narbaitz, R. Alkaline phosphatase in hyperplastic bone. Lesions of rats fed a magnesium deficient diet. In Histochemistry and Cytochemistry, Eds Takeuchi T, Ogawa K, Fujita S, Publ. Nakashani, Kyoto, Japan, 1972; 313-314.
79. Hunt, B.J., Belanger, L.F. Localized, multiform, sub-periosteal hyperplasia and generalized osteomyelosclerosis in magnesium-deficient rats. Calcif. Tiss. Res. 1972; 9:17-27.
80. Belanger, L.F., Robichon, J. The effects of magnesium deficiency on the host response to intramuscular bone matrix implanted in the rat. J. Bone Joint Surg. 1975; 57A:522-526.
81. Lai, C.C., Singer, L., Armstrong, W.D. Bone composition and phosphatase activity in magnesium deficiency in rats. J. Bone Joint Surg. 1975; 57:516-522.
82. Vormann, J., Mercker, H.J., Barrach, H.J., Stolpmann, H.J., Averdunk, R., Guenther, T. Induction of a tumour-like proliferation in the intestine of magnesium deficient rats. Magnesium Bull. 1985; 7:4-10.
83. Delbet, P., Palios, C. (Halogen salts of magnesium and experimental cancer). Bull. Acad. Med. Paris 1931; 105:508. (cited by Haury, 59)
84. Sugiura, K., Benedict, S.R. Influence of magnesium on the growth of carcinoma, sarcoma and melanoma in animals. Am. J. Cancer 1935; 23:300- 310.
85. Mills, B.J., Broghamer, B.L., Higgins, P.J., Lindeman, R.D. Inhibition of tumor growth by magnesium depletion of rats. J. Nutr. 1984; 114:739-745.
86. Yan, L., Boylan, L.M., Spallholz, J.E. Effect of dietary selenium and magnesium on human mammary tumor growth in athymic nude mice. Nutr. Cancer 1991; 16:239-248.
87. Shilovtsev, S., Shilovtseva, A. Skolnikova, S., Krichevsky, A. The prophylactic and curative effects of magnesium salts, calcium and bromides in malignant tumors. Materials of Kwibishev Med Inst 1963; 11 (cited by Bazikian, #14)
88. Gharibjian, B., Zakharian, R. Action of magnesium ions on the toxicity and antiblastomogenic activity of thiophosphamide. Rep. Armenian Acad. Sci. 30 (cited by Bazikian, #14)
89. Mori, H., Morishita, Y., Mori, Y., Yoshimi, N., Sugie, S., Tanaka, T. Effect of magnesium hydroxide on methylazoxymethanol acetate-induced epithelial proliferation in the large bowels of rats. Cancer Lett. 62:43-48, 1992.
90. Poirier, L.A., Theiss, J.C., Arnold, L.J., Shimkin, M.B. Inhibition by magnesium and calcium acetates of lead subacetate- and nickel acetate- induced lung tumors in strain A mice. Cancer Res. 1984; 44:1520-1522.
91. Kasprzak, K.S., Quander, R.V., Poirier, L.A. Effects of calcium and magnesium salts on nickel bisulfide carcinogenicity in Fischer rats. Carcinogenesis 1985; 6:1161-1166.
92. Kasprzak, K.S.,Ward, J.M., Poirier, L.A., Reichardt, D.A., Denn, A.C., Reynolds, C.W. Nickel-magnesium interactions in carcinogenesis; dose effects and involvement of natural killer cells. Carcinogenesis 1987; 7:1005-1011.
93. Kasprzak, K.S., Kiser, R.F., Weislow, O.S. Magnesium counteracts nickel-induced suppression of T-lymphocyte response to concavalin A. Magnesium 1988; 7:166-172.
94. Smialowicz, R., Rogers, R.R., Riddle, M.M., Luebke, R.W., Fogelson, L.D., Rowe, D.G. Effects of manganese, calcium, magnesium and zinc on nickel- induced suppression of natural killer cell activity. J. Toxicol. Environm. Hlth. 1987; 20:67-80.
95. Conway, K., Wang, S.W., Xu, L.S., Costa, M. Effect of magnesium on nickel-induced genotoxicity and cell transformation. Carcinogenesis 1988; 8:1115-1121.
96. Poirier, L.A., Kazprzak, K.S., Hoover, K.L., Wenk, M.L. Effects of calcium and magnesium acetates on the carcinogenicity of cadmium chloride in Wistar rats. Cancer Res. 1983; 43:4575-4581.
97. Durlach, J., Bara, M., Guiet-Bara, A., Collery, P. Relationship between magnesium, cancer and carcinogenic or anticancer metals. Anticancer Res. 1986; 6:1353-1361.
98. Alcock, N.W., Shils, M.E., Lieberman, P.H., Erlandson, R.A. Thymic changes in the magnesium depleted rat. Cancer Res. 1973; 33:2196-2204.
99. Whitfield, J.F., Perris, A.D., Youdale, T. The calcium mediated promotion of mitotic activity in rat thymocyte populations by growth hormone, neurohormones, parathyroid hormone, and prolactin. J. Cell Physiol. 1969; 73:203-212.
100. Whitney, R.B., Sutherland, R.M. The influence of calcium, magnesium and cyclic adenosine 3'5'-monophosphate on the mixed lymphocyte reaction. J. Immunol. 1972; 108:1179-1183.
101. Abboud, C.N., Scully, S.P., Lichtman, A.H., Brennan, J.K., Segel, G.B. The requirements for ionized calcium and magnesium in lymphocyte proliferation. J. Cell. Physiol. 1985; 122:64-72.
102. Brennan, J.K., Seelig, C.B., Lichtman, M.A. The role of magnesium in neutrophil production and function. In Magnesium in Health and Disease (from 2nd Intl Mg Sympos, Montreal, Canada, May, 1976), Eds. M. Cantin, M.S. Seelig, Publ. Spectrum Press, NY, 1980, pp 169-183.
103. Brennan, J.K., Lichtman, M.A., Chamberlain, J.K., Leblond, P. Isolation of variant lymphoma cells with reduced growth requirements for extracellular calcium and magnesium and enhanced oncogenicity. Blood 1976; 47:447-469.
104. Guenther, T., Averdunk, R., Wonigeit, K., Vormann, J. Characterization and growth factor production of magnesium deficiency-induced malignant T cell lymphomas. Magnesium Bull. 1988; 10:22-26.
105. Maguire M.E., Magnesium and cell proliferation. Ann. N.Y. Acad. Sci. 1988; 551:201-217.
106. Rubin, H. Central Role for Magnesium in Coordinate Control of Metabolism and Growth in Animal Cells. Proc. Natl. Acad. Sci. USA 1975; 72:3551- 3555.
107. Rubin, H., Koide, T. Mutual potentiation by magnesium and calcium of growth in animal cells. Proc. Natl. Acad. Sci. USA 1976; 73:168-172.
108. Rubin H: Differences in growth requirement and retentiveness for magnesium in nontransformed and transformed mouse 3T3 cells. Magnesium 1:41-48, 1982.
109. Morgan, J.I., Perris, A.D. The influence of sex steroids on calcium- and magnesium-induced mitogenesis in isolated rat thymic lymphocytes. J. Cell. Physiol. 1974; 83:287-296.
110. Okazaki T., Yumoto Y., Okuda T., Kato Y., Tashima M., Sawada H., Uchino H. Magnesium deprivation inhibits the expression of differentiation-related phenotypes in HL-60 Cells. Magnesium Res. 1988; 1:114. 111. Cittadini, A., Wolf,, F.I., Bossi, D., Calviello, G. Magnesium in normal and neoplastic cell proliferation: state of the art on in vitro data. Magnesium Res. 1991;4:23-33.
112. Grubbs, R.D., Maguire, M.E. Magnesium as a Regulatory Cation: Criteria and Evaluation. Magnesium 1987; 6:113-127.
113. Guenther, T. Functional compartmentation of intracellular magnesium. Magnesium 1986; 5:53-59.
114. Elin, R.J., Armstrong, W.D., Singer, L. Enzyme, adenosine triphosphate, and blood cellular changes in magnesium deficient and control rats. Proc. Soc. Exp. Biol. Med. 1971; 137:635-640.
115. Rayssiguier, Y. Lipoprotein metabolism; importance of magnesium. Magnesium 1986; 186-193.
116. Guenther, T., Vormann, J., Merker, H.J., Averdunk, R., Peter, H.W., Wonigeit, K. Membrane alterations in magnesium-deficiency-induced malignant T Cell lymphoma. Magnesium 1984; 3:29-37.
117. Averdunk, R., Guenther, T. Phospholipid metabolism and concanavalin A stimulation of thymocytes from magnesium-deficient rats and magnesium deficiency-induced T-cell lymphoma. Magnesium Bull. 1985; 7:11-15.
118. Gossrau, R., Vormann, J., Guenther, T. Enzyme Histochemistry of Malignant T Cell Lymphoma due to Chronic Magnesium Deficiency in Rats. Histochem. 1984; 80:183-186.
119. Anghileri, L.J. Magnesium concentration variations during carcinogenesis. Magnesium Bull. 1979; 1:46-48.
120. Anghileri, L.J., Collery, P., Coudoux, P., Durlach, J. (Experimental relationships between magnesium and cancer.) Magnesium Bull. 1981; 3:1-5. 121. Anghileri, L.J., Heidbreder, M., Weiler, G., Dermietzel, R. Hepatocarcinogenesis by thioacetamide: correlations of histological and biochemical changes, and possible role of cell injury. Exp. Cell. Biol. 1977; 45:34-47.
122. Blondell, J.W. The anticancer effect of magnesium. Medical Hypothesis 1980; 6:863-871.
123. Petitou, M., Tuy, F., Rosenfeld, C., Mishal, Z., Paintrand, M., Jasmin, C., Mathe, G., Inbar, M. Decreased microviscosity of membrane lipids in leukemic cells; two possible mechanisms. Proc. Natl. Acad. Sci. USA 1978; 75:2306-2310.
124. Mulay, I.L., Roy, R., Knox, B.E., Suhr, N.H., Delaney, W.E. Trace-Metal Analysis of cancerous and Non-Cancerous Human Tissues. J. Natl. Cancer Inst. 1971; 47:1-13.
125. Anghileri, L.J., Miller, E.S., Robinette, J., Prasad, K.N., Lagerborg, V.A. Calcium metabolism in tumors. II. Calcium, magnesium and phosphorus in human and animal tumors. Oncology 1971; 25:193-209.
126. Digiesi, V., Bandinelli, R., Bisceglie, P., Santoro, E. Magnesium in tumoral tissues, in the muscle and serum of subjects suffering from neoplasia. Biochem. Med. 1983; 29:360-363.
127. Szmeja, Z., Koenczewska, H. Red blood cell, serum and tissue magnesium levels in subjects with laryngeal carcinoma. J. Otorhinolaryngol. Relat. Spec. 1983; 45:102-107.
128. Ranade, S.S., Panday, V.K. Major metals in human cancer: calcium, magnesium, sodium and potassium. Sci. Total Environm. 1985; 41:79-89.
129. Taylor, J.S., Vigneron, D.B., Murphy-Boesch, J., Nelson, S.J., Kessler, H.B., Coia, L., Curran, W., Brown, T.R. Free magnesium levels in normal human brain and brain tumors: 31P chemical-shift imaging measurements at 1.5 T. Proc. Natl. Acad. Sci. USA 1991; 88:6810-6814.
130. Chandra, R.K., Newberne, P.H. 5Nutrition, Immunity and Infection. Plenum Press, New York, 1977.
131. McCoy, J.H., Kenney, M.A. Magnesium and immune function: a review. In Magnesium in Cellular Processes and Medicine. Eds: B.M. Altura, J. Durlach, M.S. Seelig, Publ. S. Karger, Basel, Switzerland 1987: 196-211.
132. Flynn, A., Loftus, M.A., Finke, J.H. Production of interleukin-1 and interleukin-2 in allogenic mixed lymphocyte cultures under copper, magnesium and zinc deficiency. Nutr. Res. 1984;4:673-679.
133. Flynn, A., Yen, B.R. Mineral deficiency effects on the generation of cytotoxic T-cells and T-helper cell factors in vitro. J. Nutr. 1981; 111:907-913.
134. Durlach, J. (Mechanisms of synergy between vitamin B6 and magnesium.) J. Med. Besancon 1969; 349-359.
135. Seelig MS: Nutritional roots of combined system disorders. In Clinical Disorders in Pediatric Nutrition. Ed. F. Lifshitz, Publ. Marcel Dekker, New York, N.Y.1982; 327-351.
136. Seelig, M.S. Possible role of magnesium in disorders of the aged. In Intervention in the Aging Process. A: Quantitation, Epidemiology, Clinical Research. Eds W. Regelson, F.M. Sinex, Publ A. Liss, New York, N.Y.1983; 279-305.
137. Durlach, J. Magnesium in Clinical Practice. (transl. by D. Wilson), Publ. John Libbey & Co, London, U.K. 1988.
138. Evans, G.W. Normal and abnormal zinc absorption in man and animals; the tryptophan connection. Nutr. Rev. 1980; 38:137-141.
139. Hsu, J.M. Zinc content in tissues of pyridoxine deficient rats. Proc. Soc. Exp. Biol. Med. 1965; 119:177-180.
140. Chandra, R.K., Au, B. Single nutrient deficiency and cell-mediated immune response. Pyridoxine. Nutr. Res. 1981; 1:101-106.
141. Beisel, W.R. Single nutrients and immunity. Am. J. Clin. Nutr. 1982; 417-468.
142. Bendich, A., Cohen, M. B vitamins: effects on specific and nonspecific immune responses. In Nutrition and Immunology Ed. R.J. Chandra, Publ. A.R. Liss, Inc. New York, N.Y. 1988; 101-123.
143. Greenberg, L.D., Bohr, D.F., McGrath, H., Rinehart, J.F. Xanthurenic acid excretion in the human subject on a pyridoxine-deficient diet. Arch. Biochem. 1949; 21:237-239.
144. Wachstein, M., Lobel, S. The relation between tryptophane metabolism and vitamin B6 in various diseases as studied by paper chromatography. Am. J. Clin. Path. 1956; 26:910-925.
145. Rose, D.P. Tryptophan metabolism in carcinoma of the breast. Lancet 1967; 1:239-241.
146. Yoshida, O., Brown, R.R., Bryan, G.T. Relationship between tryptophan metabolism and heterotopic recurrences of human urinary bladder tumors. Cancer 1970; 25:773-780.
147. Brown, R.R., Friedell, G.H., Leklem, J.E. Tryptophan metabolism in patients with bladder cancer. Am. Indust. Hyg. Assoc. 1972; 33:217-222.
148. Davis, H.L., Brown, R.R., Leklem, J., Carlson, I.H. Tryptophan metabolism in breast cancer. Cancer 1973; 31:1061-1064.
149. Gailani, S., Murphy, G., Kenny, G., Nussbaum, A. Silvernail, P. Studies on tryptophan metabolism in patients with bladder cancer. Cancer Res. 1973; 33:1071-1076.
150. Leklem, J.E., Brown, R.R. Abnormal tryptophan metabolism in a family with a history of bladder cancer. J. Natl. Cancer Inst. 1976; 1101-1104.
151. Leklem, J.E., Brown, R.R., Potera, C., Becker, D.S. A role for vitamin B6 in Cancer. In Nutrition and Cancer. Eds. J. VanEys, M.S. Seelig, B.L. Nichols, publ.SP Medical Books, New York, 1979: 249-261.
152. Bryan, G.T., Brown, R.R., Price, J.M. Mouse bladder carcinogenicity of certain tryptophan metabolites and other aromatic nitrogen compounds suspended in cholesterol. Cancer Res. 1964; 24:596-602.
153. Moynahan, E.J. Zinc deficiency and cellular immune deficiency in acrodermatitis enteropathica in man and zinc deficiency with thymic hypoplasia in Fresiam calves: a possible genetic link. Lancet 1975; 2:710.
154. Weston, W.L., Huff, J.C., Humbert, J.R. Zinc correction of defective chemotaxis in acrodermatitis enteropathica. Arch. Dermatol. 1977; 113: 422-425.
155. Fernandes, G,., Nair, M., Kazunori, O., Tanaka, T., Floyd, R., Good, R.A. Impairment of cell-mediated immunity functions by dietary zinc deficiency in mice. Proc. Natl. Acad. Sci. USA 1979; 76:457-461.
156. Gross, R.L., Osdin, N., Fong,L., Newberne, P.M. Depressed immunologic function in zinc deprived rats as measured by mitogen response of spleen, thymus and peripheral blood. Am. J. Clin. Nutr. 1979; 32:1260-1266.
157. Pekarek, R.S., Sandstead, H.H., Jacob, R.A., Barcome, D.F. Abnormal cellular immune responses during acquired zinc Deficiency. Am. J. Clin. Nutr. 1979; 32:1466-1471.
158. Cunningham-Rundles, S., Cunningham-Rundles, W. Zinc modulation of immune response. In Nutrition and Immunology. Ed. R.J. Chandra, Publ. A.R. Liss, Inc. New York, N.Y. 1988; 197-214.
159. Pories, W.J., Mansour, E.G., Strain, W.H. Trace elements that act to inhibit neoplastic growth. Ann. N.Y. Acad. Sci. 1972; 199:265-274.
160. Kasprzak,K.S., Waalkes, M.P. The role of calcium, magnesium, and zinc in carcinogenesis. Adv. Exp. Med. Biol. 1986; 206:497-515.
161. Harman, D., Heidrick, M.L., Eddy, D.E. Free radical theory of aging; effect of free radical reaction inhibitors on the immune response. J. Am. Geriatr. Soc. 1977; 25:400-407.
162. Leibovitz, B.E., Siegel, B.V. Aspects of free radical reactions in biological systems. J. Gerontol. 1980. 35:45-56.
163. Menkes, M.S., Comstock, G.W., Vuilleumier, J.P., Helsing, K.J., Rider, A.A., Brookmeyer R. Serum Beta-Carotene, Vitamins A and E, Selenium, and the Risk of Lung Cancer. New Engl. J. Med. 1986; 315:1250-1254.
164. Goldsmith, L.A. Relative magnesium deficiency in the rat. J. Nutr. 1967; 93:87-102.
165. Blaxter, K.L., Wood, W.A. The nutrition of the young ayreshire calf. 9. Composition of the tissues of normal and dystrophic calves. Brit. J. Nutr. 1952; 6:144-163.
166. Schwarz, K. Vitamin E, trace elements, and sulfhydryl groups in respiratory decline. Vitamins Hormones. 1962; 20:463-484.
167. Zuckerman, L. Marquardt, G.H. Muscle, erythrocyte, and plasma electrolytes and other muscle constituents of rabbits with nutritional muscular dystrophy. Proc. Soc. Exp. Biol. Med. 1963; 112:609-610.
168. Tansy, M.F. Intestinal absorption of magnesium. In Intestinal Absorption of Metal Ions, Trace Elements, and Radionuclides. Eds. S.C. Skoryna, D. Waldron-Edwards. Publ. Pergamon Press, New York 1970; 193-210.
169. Blount, H.C.: Effect of magnesium on the response of mice to large doses of whole-body irradiation. Radiology 1955; 65:250-253.
170. Tansy, M.F., Nichini, F.M., Baker, H.W., Chrzyanowski, J. Association of low serum magnesium concentration with severity of gastrointestinal symptomatology in the irradiated patient. J. Surg. Res. 1971; 11:213-216. 171. Nichini, F.M., Tansy, M.F., Kendall, F.M. Serum magnesium fall in radiation-induced gastrointestinal symptomatology. Radiology 1973; 108:413-415.
172. Evard, D., Sebag, A., Cosnes, J., Gendre, J.P. (Hypomagnesemia in enteritis from chronic irradiation). Med. Chir. Dig. 1983; 12:509-513.
173. Cohen, L., Kitzes, R. Early radiation-induced proctosigmoiditis responds to magnesium therapy. Magnesium 1985; 4:16-19.
174. Bell, D.R., Woods, R.L., Levi, J.A. Cis-diaminedichloroplatinum-induced hypomagnesemia and renal magnesium wasting. Europ. J. Cancer Clin. Oncol. 1985; 21:287-290.
175. Vogelsang, N.J., Torkelson, Kennedy, B.J. Hypomagnesemia, renal dysfunction, and Raynaud's phenomenon in patients treated wth cisplatin, vinblastine and bleomycin. Cancer 1985; 56:2765-2770.
176. Mavichak, V., Coppin, C.M., Wong, N.L., Dirks, J.H., Walker, V., Sutton R.A. Renal magnesium wasting and hypocalciuria in chronic cis-platinum nephropathy in man. Clin. Sci. 1988; 75:203-207.
177. Daugaard, G., Abildgaard, U., Holstein-Rathlou, N.H., Bruunshuus, I., Bucher, D., Leyssac, P.P. Renal tubular function in patients treated with high-dose cisplatin. Clin. Pharmacol. Ther. 1988; 44:164-172.
178. DeLeeuw, I., De Beukelaer, T., Hartoko, T., Van Gaal, L., Vandewoude, M. Effects of cisplatinum and cyclosporin on magnesium status in clinical oncology. Magnesium Res. 1988. 1:115, 1988.
179. Markmann, M., Rothman, R., Reichman, B., Hakes, T., Lewis, J.L. Jr., Rubin, S., Jones, W., Almadrones, L., Hoskins, W. Persistent hypomagnesemia following cisplatin chemotherapy in patients with ovarian cancer. J. Cancer Res. Clin. Oncol. 1991; 117:89-90.
180. Abbasciano, V., Mazzotta, D., Vecchiatti, G., Tassinari, D., Nielsen, I., Sartori, S. Changes in serum, erythrocyte, and urinary magnesium after a single dose of cisplatin combination chemotherapy. Magnesium Res. 1991; 4:123-125.
181. Cappelaere, P., Vincent, A., Staumont, M., Dupuis, B., Gautier, P., Adenis, L. (Continuous Holter cardiac monitoring and chemotherapy by combination with platinum and fluoro-uracil.) Bull. Cancer Paris 1991; 78:261-272.
182. Willcox, J.C., McAllister, E.J., Sangster, G., Kaye, S. Effects of magnesium supplementation in testicular cancer patients receiving cisplatin: a randomized trial. Brit. J. Cancer 1986; 54:19-23.
183. Martin, M., Diaz-Rubio, E., Casado, A., Lopez-Vega, J.M., Sastre, J., Almenarez, J. Intravenous and oral magnesium supplementations in the prophylaxis of cisplatin-induced hypomagnesemia. Results of a controlled trial. Am. J. Clin. Oncol. 1992; 15:348-351.
184. Binet, A., Volfin, P. Effect of an Anti-tumor Platinum complex, Pt (II) Diamino-toluene on mitochondrial membrane properties. Biochim Biophys Acta 1977; 161:182-187.
185. Theophanides, T., Polissiou, M. Magnesium-nucleic acid conformational changes and cancer. Magnesium 5:221-233.
186. Ekimoto, H., Okada, M., Mashiba, H., Shibazaki, C., Takahashi, K. Protection of cisplatin-induced nephrotoxicity by magnesium ion. Magnesium Bull. 12:67, 1990. (from J. Japanese Soc. Mg.Res. 8, 1989).
187. Davey, P., Gozzard, D., Goodall, M., Leyland, M.J. Hypomagnesaemia: an underdiagnosed interaction between gentamicin and cytotoxic chemotherapy for acute non-lymphoblastic leukaemia. J. Antimicrob. Chemother. 1985. 15:623-628.
188. Seelig, M.S. Amphotericin B binding of magnesium: contribution of its toxicity, and therapeutic implications. Magnesium Bull. 1981; 3:80-84.
189. Parsons, F.M., Edwards, G.F., Anderson, C.K., Ahmad, S., Clark, P.B., Hetherington, C., Young, G.A. Regression of malignant tumours in magnesium and potassium depletion induced by diet and haemodialysis. Lancet 1974; 1:243-244.
190. Burman, N.D., Parsons, F.M. Hyperalimentation in the treatment of advanced carcinoma with induced magnesium and potassium depletion. S.A. Med. Tydskrif. 1976; Oct 2:1695-1702.
191. Collery, P., Choisy, H., Millart, H., Pluot, M., Gourdier, B., Simoneau J.P., Charpentier, F., Pechery, C., Coudoux, P. [Is antitumor capability of gallium due to its effect as a competitive inhibitor vis-a-vis magnesium?] Magnesium Bull. 1981; 3:23-25.
192. Manfait, M., Collery, P. ([Role of magnesium and gallium ions on the DNA conformation. In vitro study by Raman spectroscopy.) Magnesium Bull. 1984; 6:153-155.
193. Anghileri, L.J, Robert, J. Radiogallium as a probe for magnesium-binding sites. Magnesium Bull. 1982; 4:197-200.
194. Collery, P., Millart, H., Pluot, M., Anghileri, L.J. Effects of gallium chloride oral administration on transplanted C3HBA mammary adenocarcinoma: Ga, Mg, Ca and Fe concentration and anatomopathological characteristics. Anticancer Res. 1986;1085-1087.
195. Paunier, L., Radde, I.C.: Normal and abnormal magnesium metabolism. Bull. of Hosp. for Sick Childr. (Toronto) 1965; 14:16-23.
196. Paunier, L., Radde, I.C., Kooh, S.W., Conen, P.E.E., Fraser, D. Primary hypomagnesemia with secondary hypocalcemia in an infant. Pediatrics 1968; 41:385-402.
197. Vainsel, M., Vanderville, G., Smulders, J., Vosters, M., Hubain, P., Loeb, H. Tetany due to hypomagnesemia with secondary hypocalcemia. Arch. Dis. Child. 1970; 45:254-258.
198. Seelig, M.S. Prenatal and neonatal mineral deficiencies: magnesium, zinc and chromium. In Clinical Disorders in Pediatric Nutrition Ed. F. Lifshitz, Publ. Marcel Dekker, Inc. New York, 1982; 167-196.
199. Seelig, M.S. Magnesium in pregnancy: special needs for the adolescent mother. J. Am. Coll. Nutr. 1991; 10:566.
200. Duggin, G.G., Dale, N.E., Lyneham, R.C., Evans, R.A., TIller, D.J. Calcium balance in pregnancy. Lancet 1974; 2:926-927.
201. Avioli, L.V. The calcium controversy and the recommended dietary allowance. In The Osteoporotic Syndrome, Detection, Prevention and Treatment., Ed L.V. Avioli, Publ. Grune & Stratton, Inc, Orlando FL, 1987; pp 57-66.
202. Seelig, M.S. Increased need for magnesium with the use of combined oestrogen and calcium for osteoporosis treatment. Magnesium Res. 1990; 3:197-215.
203. Henrotte, J.G.,, Columbani, J., Pineau, M., Dausset, J. Role of H-2 and non H-2 genes in control of blood magnesium levels. Immunogenetics 1984; 19:435-448.
204. Skyberg, D., Stromme, J.H., Nesbakken, R., Harnaes, K. Congenital primary hypomagnesemia, an inborn error of metabolism. Acta Paediat. Scand. 1967; 177:26-27.
205. Stromme, J.H., Nesbakken, R., Normann, T., Skjorten, F., Skyberg, D., Johannessen, B. Familial hypomagnesemia. Biochemical, histological and hereditary aspects studied in two brothers. Acta Paediat. Scand. 1969; 58:433-444.
206. Nordio, S., Donath, A., Macagno, F., Gatti, R. Chronic hypomagnesemia with magnesium dependent hypocalcemia I. A new syndrome with intestinal malabsorption. II. Magnesium, calcium and strontium. Acta paediat. Scand. 1971; 60:441-448, 449-455.
207. Paunier, L. Magnesium malabsorption. Adv. Intern. Med. Pediatr. 1979; 42:113-131.
208. Freeman, R.M., Pearson, E. Hypomagnesemia of unknown etiology. Am. J. Med. 1966; 41:645-656.
209. Gitelman, H.J., Graham, J.B., Welt, L.G. A new familial disorder characterized by hypokalemia and hypomagnesemia. Trans. Assoc. Am. Physicians 1966; 79:221-235.
210. Sutherland, L.E., Hartroft, P., Balis, J.U., Bailey, J.D., Lynch, M.J. Bartter's syndrome. A report of four cases, including three in one sibship, with comparative histologic evaluation of the juxtaglomerular apparatuses and glomeruli. Acta Paediat. Scand. 1970; Suppl. 201:1-25.
211. Rodriguez-Soriano, J., Vallo, A., Garcia-Fuentes, M. Hypomagnesaemia of hereditary renal origin. Pediatr. Nephrol. 1987; 1:465-472.
212. Bianchetti, M.G., Girardin, E., Benador-Milsztajn, N., Sizonenko, P.C., Paunier, L. Metabolic studies in primary tubular hypomagnesaemia-hypokalaemia. Magnesium Res. 1988; 1:79-83.
213. Pronicka, E., Gruszczynska, B. Familial hypomagnesaemia with secondary hypocalcaemia--autosomal or X-linked inheritance? J. Inherit. Metab. Dis. 1991; 14:397-399.
214. Henrotte, J.G., Gluckman, E. (Family studies on red blood cell magnesium in leukemia and aplasia.) Magnesium Bull. 1982; 4:93-97.
215. Collery, P., Coudoux, P., Geoffrey, H. Role of magnesium in venous thrombogenesis in cancer: changes in magnesium levels in neoplastic diseases. In Nutrition and Cancer (Proc. 18th Ann Mtg of Am Coll Nutr, 1977), Eds. J. vanEys, M.S. Seelig, B.L. Nichols, Publ. SP Med & Sci Books, 219-231, 1979.
216. Collery, P., Coudoux, P., Geoffrey, H. Magnesium and thrombosis: interrelations with latent tetany, cirrhosis, and cancer. In Nutrition and Heart Disease. (Proc. 19th Ann Mtg of Am Coll Nutr, 1978), Ed H.K. Naito, Publ. SP Med & Sci Books, 325-334, 1982.
217. Darlu, P., Henrotte, J.G. The importance of genetic and constitutional factors in human red blood cell magnesium control. In Magnesium in Health and Disease. (from 2nd Intl Mg Sympos, Montreal, Canada, 1976), Eds. M. Cantin and M.S. Seelig, Publ. Spectrum Press, NY, 1980; 921-927.
218. Henrotte, J.G. (Genetic factors of magnesium metabolism regulation in man.) Magnesium Bull. 1981; 3(1a):237-248.
219. Feray, J.C., Franck, G., Garay, R., Henrotte, J.G. Inter-individual differences in red cell Mg2+ contents are related to the activity of a Na+:Mg2+ exchanger; possible relationship with HLA-associated genetic factors. Magnesium Res. 1989; 2:124.
220.-Kaufman C.E. Disorders of potasium, calcium, magnesium and phosphorus. Prog. Crit. Care. Med. 1985;2:186-205.
221.-Blanco Coronado J.L. Alteraciones del metabolismo del calcio, fósforo y magnesio. Ginestal Gomez RJ. Editor. Libro de texto de Cuidados Intensivos. Editorial Libro del año 1991; 705-714.
222.-Bilezikian J.P. Management of acute hypercalcemia. NEJM 1992;326;1196-1203.
223.- Zaloga GP. Hypocalcemia in critically ill patients. Critical Care Medicine, 1992;20: 251-262.
224.-Ginestal Gomez RJ. Guía de Terapéutica Farmacológica del Paciente. Editorial libro del año. Madrid 1993.
225.-Desai TK. Hypocalcemia and hypophosphatemia in acutely ill patients. Crit. Care Clin, 1987,5: 927-941..
226.-Roswell RH. Severe hypercalcemia. Causes and specific therapy. J. Crit. Illness 1987;2: 14-21.
227.-Marino P L . Medicina Critica y Terapia Intensiva. Editorial Médica Panamerica 1993.
228.-Reinhart R.A. Magnesium metabolism. A review with special reference to the relationship between intracellular content and serum level. Arch. Intern. Med. 1988, 148:; 2415-2420.
229.- Whang R.: Magnesium deficiency: Pathogenesis, prevalence, and clinical implications. Am. J. Med. 1987, 87: 24-29.
230.-Ryzen E. and colbs. Magnesium deficiency in a medical ICU population. Critical Care Medicine, 1985: 13: 19-21.
231.-Iseri LT y cols. Magnesium in Coronary Artery Disease. Drugs 1984, 28: 151-160.
233.-Laban E., Charbon GA:. Magnesium and cardiac arrhytmias . Nutrient ór Drug? . J. Am.Coll Nutr.1986: 5, 521-532.
234.- Wester PO: Magnesium. Am. J. Clin. Nutri, 1987;45 (1305-1312).
235.-R.J Ginestal y cols. Manual del Paciente grave. Editorial Proyectos Médicos, 1997.
237.-Ripple and cols. Intensive Care Medicine. Edit. Litle Brown and Company 1991.
238.-Zimermman J.C and cols. Critical Care Support. S.C.C.M -96.-
239.-John J. Marini and Arthur P. Wheeler. Second Edition. Critical Care Medicine-1996.
240.-Gary P. Zaloga. Multidisciplinary Critical Care Bord Review Course. Society of Critical Care Medicine-1996.
241.-Kinast Horacio. Ion magnesio. Su importancia vital. Documento CIIED Centro Interamericano de Información y Estudios para el Desarrollo 1987 No.3
242.-Rosselot E. Y Cols. Manual de Medicina Intensiva 1987 Publicaciones Técnicas Mediterráneo Ltda
REFERENCIAS BIBLIOGRAFICAS SOBRE USO DEL LASER EN REGENERACIÓN TISULAR
Van Breugel HH, Engels C, Bar PR. Mechanisms of action in laser-induced photobiomodulation depend on the waveleght of the laser. Lasers Surg Med 1993;13(Suppl 5):36 a.
Wei Y, Naim JO, Lanzafame RJ. The effects of laser irradiation on the release of fibroblast growth factor from 373 fibroblast in vitro. Lasers Surg Med 1993;13(Suppl 5):39a.
Kim KS, Lee DH, Kim SG. Effects of low incident energy levels of infrared laser irradiation on the proliferation of streptococcus mutans. Laser Ther 1992;4:81-5.
Van Kooten DW, Maciunas RJ, Carver RS. Low levels CO laser-induced release of chromiun from canine 2C5 gliosarcoma cells. Lasers Surg Med 1993;13:517-21.
Van Bergel HF, Engels C, Van Ginkel G, Bar PR. Efficacy of laser-induced photobinomodulation depends on the wavelength of the laser. Laser Ther 1994;6:28-9.
Riugauj J, Trelles MA, Calderhead RG, Mayayo E. Changes in fibroblast proliferation and metabolism following in vitro helium-neon laser irradiation. Laser Ther 1991;3:25-34.
Friedmann H, Lubart R, Towards an explanation of visible and infrared laser induced stimulation and damage of cell cultures. Laser Ther 1992;4:39-42.
Logan ID, Bristow HE, Barnett YA. The induction of DNA repair in X-Ray irradiated fried erythroleukaemia and human myeloid HL60 cells by low intensy laser irradiation. Laser Ther 1994;6:189-94.
O'Kane S, Shields TD, Gilmore WS, Allen JM. Low intensity laser irradiation inhibits tritiated Thymidine incorporation in the haemopoietic cell lines H160 and U937. Lasers Surg Med 1994;14:34-9.
O'Kane S, Callaghan GA, Hannigan BM, Gilmore WS, Allen JM. Low intensity laser irradiation induces cytokine release from two haemopoietic cell lines. Lasers Surg Med 1994;6:8--10.
Bolton P, Young S, Dyson M. The direct effect of 860 nm ligth on cell proliferation and on succinic dehydrogenase activity on human fibroblasts in vitro. Laser Ther 1995;7:55-60.
Karu T. Molecular mechanisms of the therapeutic effect of low-intensity laser radiation. Laser Life Sci 1988;2:53-74.
Aggarwall BB, Quintanilha AT, Cammack R, Parker L. Damage to mitochondrial electron transport and energy coupling by visible light. Biochem Biophys Acta 1988;502:367--82.
Lovschall H, Arenholdt-Bindslev D. Low levels laser therapy effect on mitocondrial rhodamine 123 uptake in human oral fibroblast. Laser Ther 1994;6:30-1.
Noguerol BF, Alandez FJ, Cañizares J, Sicilia A, Sanz M, Campos A, et al. Ultrastructural changes of the mouse periodontium after He Ne laser radiation: a transmission electron microscopic study. Laser Ther 1994;6:95-100.
Enwemeka ChS, Cohen-Kornberg E, Duswalt EP, Weber DM, Rodríguez IM. Biochemical effects of three different periods of GAAL laser photostimulation on tenotomized tendons. Laser Ther 1994;6:181-8.
Rigan J, Trelles MA. Sun ChH, Berns MW. Influence of low incident levels of laser energy on the behaviour of human fibroblasts in vivo and in vitro. Laser Ther 1994;6:11.
Al-Watban FAH, Zhang Z. Dosimetry-related wound healing response in the rat model following helium neon laser LL LT. Laser Ther 1994;6:119-24.
Mester AF, Mester A. Wound healing. laser Ther 1989;1:7-15.
Karu T. Photobiology of low-power laser effects. Healt Phys 1989;56:591-704.
Colver GB, Priestley GC. Failure of a helium-neon laser to affect components of wound healing in vitro. Br Med J 1989;121:179-89.
Al Wathan FAH, Zhang Z. Towards optimun dosimetric parameters for the effects of laser therapy on wound healing. Laser Surg Med 1993;13(Suppl 5):10.
Ghamsari SM, Yamada H, Acorda JA, Unno N. Evaluation of low levels laser therapy on open wound healing of the teat in dairy cattle. Laser Ther 1994;6:113-8.
Kameya T, Ide S, Acorda JA, Yamada H, Taguchi H, Abe N. Effect of different wavelengths of low level laser therapy on wound healding in mice. Laser Ther 1995;7:33-6.
Anders J, Borke R, Woolery S, Van de Merwe W. Low power laser irradiation alters the rate of regeneration of the rat facial nerve. Laser Surg Med 1993;13:72-82.
Lowe AS, Baxter GD, Walsh DM, Allen JM. Effect of 380 nm continuons wave laser diode irradiation on medial nerve function in normal subjects. Laser Surg Med 1993;13:597-604.
Luger EI, Wollman Y, Rochkind S, Devel S, Korenstein R. The effects of low incident levels of laser radiation on clonal bone cells. Laser Ther 1994;6:56.
Dickson GR, Clingen H, Jordan GR, Linton T. The effect of low level laser therapy on alkaline phosphatase expresion during fracture repair. Laser Ther 1994;6:16-7.
Glinkowski W, Rowinsky J. Effect of low incident levels of infrared laser energy on the healing of experimental bone fracture. Laser Ther 1995;7:67-70.
Chen J, Zhou Y. Effect of low level carbon dioxide laser radiation on biochemical metabolism of rabbit mandibular bone callus. Laser Ther 1989;1:83-7.
Trelles MA, Mayayo E. Bone fracture consolidates faster with low power laser. Lasers Surg Med 1987;7:36-45.
Aussel A, Le Brun JC, Badoux JC. Generating acoustic waves by laser: theoretical and experimental study of the emission source. Ultrasonic 1988;26:245-55.
Pilla AA, Nasser PR, Khan SA, Figueiredo M, Kavfman JJ, Siffert RS. Non-invasive low-intensity pulse ultrasound accelerates bone healing in the rabbit. J Orthop Traum 1990;4:246-53.