ACADEMIA IBEROAMERICANA DE MEDICINA BIOLOGICA Y ODONTOESTOMATOLOGIA | home

Capitulo 6 - MEMBRANA CELULAR -CONDUCTORES BIOLÓGICOS Y SU PATOLOGÍA
Los avances de la Biofisica nos permiten en la actualidad el poder comprender muchos fenómenos que afectan el comportamiento integral del organismo humano. La Biofisica, Biologia Molecular , Toxicologia celular y de la matrix extracelular, nos explican la razon de ser de la Medicina Biológica y por que elloes un avance no considerado en los tratados propios de la Medicina Clasica.
El material que he seleccionado a continuacion permite al interesado en estas materias ponerse al dia en estos avances.
COMPOSICION DE LA MEMBRANA PLASMATICA
La MEMBRANA PLASMATICA de una típica célula animal está compuesta por un 50% de lípidos y un 50% de proteínas. Sin embargo, como las proteínas son mucho más voluminosas que los lípidos hay 50 moléculas de estos últimos por cada molécula de proteína.
LIPIDOS DE LA MEMBRANA
Aproximadamente el 75% de los lípidos son FOSFOLÍPIDOS, lípidos que contienen fósforo.
En menores proporciones también está el colesterol y los glicolípidos, que son lípidos que contienen un o varios monosacáridos únidos.
Estos fosfolípidos forman una bicapa lipídica debido a su carácter AMFIPATICO, es decir por tener una cabeza hidrófila y una cola hidrófoba.
La cabeza está formada por un fosfato de un compuesto nitrogenado (colina o etanolamina) y se mezcla bien con el agua.
La cola está formada por ácidos grasos que repelen en agua.
Las moléculas de la bicapa están orientadas de tal forma que las cabezas hidrófilas están cara al citosol y al líquido extracelular y las colas se enfrentan hacia en interior de la membrana
Hay cuatro tipos de fosfolípidos en la membrana celular:
FOSFATIDILCOLINA
ESFINGOMIELINA (en este fosfolípido la glicerina ha sido sustituída por un aminoalcohol llamado D-4-esfingenina)
La composición de la capa interna y externa de lípidos no es la misma, dependiendo de la presencia de proteinas que requieren unirse a determinados fosfolípidos
Los glicolípidos (5% de los lípidos de membrana) son también anfipáticos y se encuentran sólo en la parte extracelular de la membrana.
Son importantes para mantener la adhesión entre las células y tejidos y pueden contribuir a la comunicación y reconocimiento entre células. Son el blanco de ciertas tóxinas bacterianas.
Uno de los más importantes glicolípidos de membrana es el galactocerebrósido, uno de los principales componentes de la mielina, el aislamiento lipídico de las fibras nerviosas
Los restantes 20% de los lípidos de la membrana están constituídos por moléculas de colesterol que se incluyen entre los fosfolípidos a ambos lados de la membrana. Las moléculas de colesterol confieren una mayor fortaleza a las membranas aunque disminuyen su flexibilidad. Las membranas de las plantas carecen de colesterol.
La capa de fosfolípido es dinámica porque las moléculas de lipidos resbalan de un lado para otro e intercambian su sitio dentro de la misma capa. Igualmente, la bicapa es autosellante: si se perfora con una aguja, al retirar esta el orificio se cierra,
PROTEINAS DE MEMBRANA
Se conocen a la fechas dos tipos :
Proteínas integrales: son aquellas que cruzan la membrana y aparecen a ambos lados de la capa de fosfolípidos. La mayor parte de estas proteínas son glicoproteinas, proteínas que tiene unidos uno varios monosacáridos. La parte de carbohidrato de la molécula está siempre de cada al exterior de la célula
Proteínas periféricas: están no se extienden a lo ancho de la bicapa sino que están unidas a las superficies interna o externa de la misma y se separan fácilmente de la misma, La naturaleza de las proteínas de membrana determina su función:
Canales: proteínas integrales (generalmente glicoproteínas) que actúan como poros por los que determinadas sustancias pueden entrar o salir de la célula
Transportadoras: son proteínas que cambian de forma para dar paso a determinados productos
Receptores: Son proteínas integrales que reconocen determinadas moléculas a las que se unen o fijan. Estas proteínas pueden identificar una hormona, un neurotransmisor o un nutriente que sea importante para la función celular. La molécula que se une al receptor se llama ligando.
Enzimas: pueden ser integrales o periféricas y sirven para catalizar reacciones a en la superficie de la membrana
Anclajes del citolesqueleto: son proteínas periféricas que se encuentran en la parte del citosol de la membrana y que sirven para fijar los filamentos del citoesqueleto.
Marcadores de la identidad de la célula: son glicoproteínas y glicolípidos características de cada individuo y que permiten identificar las células provenientes de otro organismo. Por ejemplo, las células sanguíneas tienen unos marcadores ABO que hacen que en una transfusión sólo sean compatibles sangres del mismo tipo. Al estar hacia el exterior las cadenas de carbohidratos de glicoproteínas y glicolípidos forma una especie de cubierta denominada glicocalix
FISIOLOGIA DE LA MEMBRANA
La función de la membrana es la de proteger el interior de la célula frente al líquido extracelular que tiene una composición diferente y de permitir la entrada de nutrientes, iones o otros materiales específicos. También se intercomunica con otras células a través de las hormonas, neurotransmisores, enzimas, anticuerpos, etc.
GRADIENTE ELECTROQUIMICO
El gradiente electroquímico es debido a que el numero de iones (partículas cargadas) del líquido extracelular es muy diferente del del citosol.
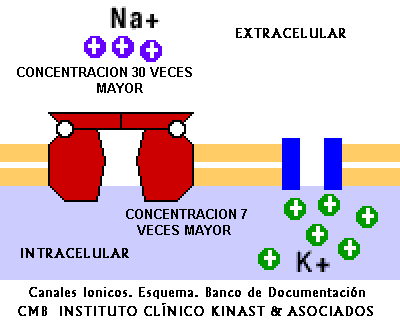
En el líquido extracelular los iones más importantes son el Na+ y el Cl-, mientras que en el interior de la célula predomina el K+ y fosfatos orgánicos aniónicos.
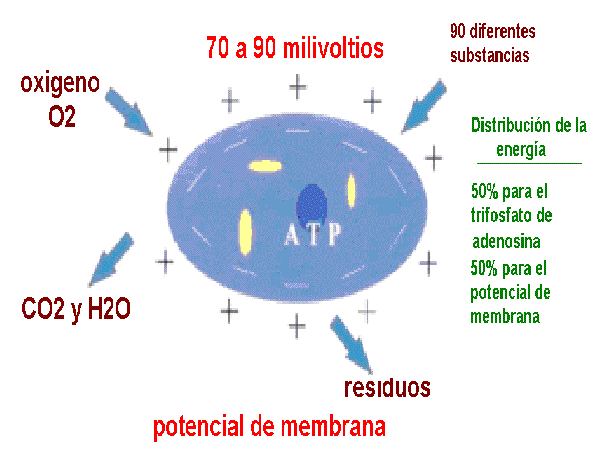
Como resultado de esto, existe una diferencia de potencial eléctrico a través de la membrana (potencial de membrana) que se mide en voltios. El voltaje en las células vivas es de -50 a -90 mV (milivoltios), representando el signo negativo que el interior es más negativo que el exterior. En algunas condiciones especiales, algunas células pueden tener un potencial de membrana positivo (algunos autores hablan entre 20-200.
PERMEABILIDAD SELECTIVA
La membrana plasmática regula la entrada y salida de materiales, permitiendo la entrada de unos y restingiendo el paso de otros. Esta propiedad se llama permeabilidad selectiva
La membrana es permeable cuando permite el paso, más o menos fácil, de una sustancia. La permeabilidad de la membrana depende de varios factores relacionados con las propiedades físico-químicas de la sustancia:
Solubilidad en los lípidos: Las sustancias que se disuelven en los lípidos (moléculas hidrófobas, no polares) penetran con facilidad en la membrana dado que esta está compuesta en su mayor parte por fosfolípidos.
Tamaño: la mayor parte de las moléculas de gran tamaño no pasan a través de la membrana. Sólo un pequeño número de moleculas no polares de pequeño tamaño pueden atravesar la capa de fosfolípidos
Carga: Las moleculas cargadas y los iones no pueden pasar, en condiciones normales, a través de la membrana. Sin embargo, algunas sustancias cargadas pueden pasar por los canales proteícos o con la ayuda de una proteína transportadora.
También depende la permeabilidad de una membrana de la naturaleza de las proteínas de membrana existentes:
Canales: algunas proteínas forman canales llenos de agua por donde pueden pasar sustancias polares o cargadas eléctricamente que no atraviesan la capa de fosfolípidos.
Transportadoras: otras proteínas se unen a la sustancia de un lado de la membrana y la llevan del otro lado donde la liberan.
En general, estos canales y proteínas transportadoras muy altamente selectivas permitiendo el paso a un única sustancia
TRANSPORTE DE MATERIALES A TRAVES DE LAS MEMBRANAS PLASMATICAS
Los mecanismos que permiten a las sustancias cruzar las membranas plasmáticas son esenciales para la vida y la comunicación de las células. Para ello, la célula dispone de dos procesos:
Transporte pasivo :cuando no se requiere energía para que la sustancia cruce la membrana plasmático
Transporte Activo cuandondo la célula utiliza ATP como fuente de energía pasa hacer atravesar la membrana a una sustancia en particular
TRANSPORTE PASIVO
Los mecanismos de transporte pasivo son:
Difusión Simple
Las moléculas en solución están dotadas de energía cinética y, por tanto tienen movimientos que se realizan al azar. La difusión consiste en la mezcla de estas moléculas debido a su energía cinética cuando existe un gradiente de concentración, es decir cuando en una parte de la solución la concentración de las moléculas es más elevada. La difusión tiene lugar hasta que la concentración se iguala en todas las partes y será tanto más rápida cuanto mayor sea energía cinética (que depende de la temperatura) y el gradiente de concentración y cuanto menor sea el tamaño de las moléculas.
Algunas sustancias como el agua, el oxígeno, dióxido de carbono, esteroides, vitaminas liposolubles, urea, glicerina, alcoholes de pequeño peso molecular atraviesan la membrana celular por difusión, disolviendose en la capa de fosfolípidos.
Algunas sustancias iónicas también pueden cruzar la membrana plasmática por difusión, pero empleando los canales constituídos por proteínas integrales llenas de agua. Algunos ejemplos notables son el Na+, K+, HCO3, Ca++, etc.
Debido al pequeño tamaño de los canales, la difusión a través de estos es mucho más lenta que a través de la bicapa fosfolipídica
Osmosis
Es otro proceso de transporte pasivo, mediante el cual, un disolvente - el agua en el caso de los sistemas biológicos - pasa selectivamente a través de una membrana semi-permeable.
La membrana de las células es una membrana semi-permeable ya que permite el paso del agua por difusión pero no la de iones y otros materiales.
Si la concentración de agua es mayor (o lo que es lo mismo la concentración de solutos menor) de un lado de la membrana es mayor que la del otro lado, existe una tendencia a que el agua pase al lado donde su concentración es menor.
El movimiento del agua a través de la membrana semi-permeable genera un presión hidrostática llamada presión osmótica.
La presión osmótica es la presión necesaria para prevenir el movimiento neto del agua a través de una membrana semi-permeable que separa dos soluciones de diferentes concentraciones.
La ósmosis puede entenderse muy bien considerando el efecto de las diferentes concentraciones de agua sobre la forma de las células. Para mantener la forma de un célula, por ejemplo un hematíe, esta debe estar rodeada de una solución isotónica, lo que quiere decir que la concentración de agua de esta solución es la misma que la del interior de la célula. En condiciones normales, el suero salino normal (0.9% de NaCl) es isotónico para los hematíes.
Si los hematíes son llevados a una solución que contenga menos sales (se dice que la solución es hipotónica), dado que la membrana celular es semi-permeable, sólo el agua puede atravesarla. Al ser la concentración de agua mayor en la solución hipotónica, el agua entra en el hematíe con lo que este se hincha, pudiendo eventualmente estallar (este fenómeno se conoce con el nombre de hemolisis.
Por el contrario, si los hematíes se llevan a una solución hipertónica (con una concentración de sales superior a la del hematíe) parte del agua de este pasará a la solución produciéndose el fenómeno de crenación y quedando los hematiés como "arrugados".
Ultrafiltración
En este proceso de transporte pasivo, el agua y algunos solutos pasan a través de una membrana por efecto de una presión hidrostática.
El movimiento es siempre desde el área de mayor presión al de menos presión. La ultrafiltración tiene lugar en el cuerpo humano en los riñones y es debida a la presión arterial generada por el corazón
Esta presión hace que el agua y algunas moléculas pequeñas (como la urea, la creatinina, sales, etc) pasen a través de las membranas de los capilares microscópicos de los glomérulos para ser eliminadas en la orina.
Las proteínas y grandes moléculas como hormonas, vitaminas, etc., no pasan a través de las membranas de los capilares y son retenidas en la sangre.
Difusión facilitada
Algunas moléculas son demasiado grandes como para difundir a través de los canales de la membrana y demasiado insolubles en lípidos como para poder difundir a través de la capa de fosfolípidos.
Tal es el caso de la glucosa y algunos otros monosacáridos. Esta sustancias, pueden sin embargo cruzar la membrana plasmática mediante el proceso de difusion facilitada, con la ayuda de una proteina transportadora.
En el primer paso, la glucosa se une a la proteína transportadora, y esta cambia de forma, permitiendo el paso del azúcar.
Tan pronto como la glucosa llega al citoplasma, una kinasa (enzima que añade un grupo fosfato a un azúcar) transforma la glucosa en glucosa-6-fosfato.
De esta forma, las concentraciones de glucosa en el interior de la célula son siempre muy bajas, y el gradiente de concentración exterior --> interior favorece la difusión de la glucosa.
La difusión facilitada es mucho más rápida que la difusión simple y depende:
a) del gradiente de concentración de la sustancia a ambos lados de la membrana
b) del número de proteínas transportadoras existentes en la membrana
c) de la rápidez con que estas proteínas hacen su trabajo
La insulina, una hormona producida por el páncreas, facilita la difusión de la glucosa hacia el interior de las células, disminuyendo su concentración en la sangre. Esto explica el porque la ausencia o disminuciòn de la insulina en la diabetes mellitus aumenta los niveles de glucosa en sangre al mismo tiempo que obliga a las células a utilizar una fuente de energía diferente de este monosacárido
TRANSPORTE ACTIVO Y OTROS PROCESOS ACTIVOS
Algunas sustancias que son necesarias en el interior de la célula o que deben ser eliminadas de la misma no pueden atravesar la membrana celular por ser muy grandes, llevar una carga eléctrica o porque deben vencer un gradiente de concentración.
Para estos casos, la naturaleza ha desarrollado el transporte activo, un proceso que consume energía y que requiere del concurso de proteínas integrales que actúan como "bombas" alimentadas por ATP, para el caso de moléculas pequeñas o iones y el transporte grueso específico para moléculas de gran tamaño como proteínas y polisacáridos e incluso células enteras como bacterias y hematíes
Transporte activo
Por este mecanismo pueden ser transportados hacia el interior o exterior de la célula los iones H+ (bomba de protones) Na+ y K+ (bomba de sodio-potasio), Ca++ , Cl-, I, aminoácidos y monosacáridos. Hay dos tipos de transporte activo:
Transporte activo primario: en este caso, la energía derivada del ATP directamente empuja a la sustancia para que cruce la membrana, modificando la forma de las proteínas de transporte (bomba) de la membrana plasmática.
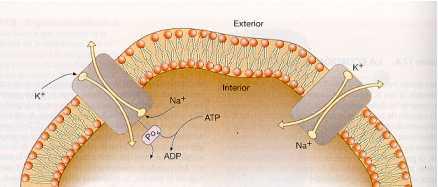
El ejemplo más característico es la bomba de Na+/K+, que mantiene una baja concentración de Na+ en el citosol extrayéndolo de la célula en contra de un gradiente de concentración.
También mueve los iones K+ desde el exterior hasta el interior de la célula pese a que la concentración intracelular de potasio es superior a la extracelular.
Esta bomba debe funcionar constantemente ya que hay pérdidas de K+ y entradas de Na+ por los poros acuosos de la membrana.
Esta bomba actúa como una enzima que rompe la molécula de ATP y también se llama bomba Na+/K+-ATPasa. Todas las células poseen cientos de estas bombas por cada um2 de membrana.
Transporte activo secundario: La bomba de sodio/potasio mantiene una importante diferencia de concentración de Na+ a través de la membrana.
Por consiguiente, estos iones tienen tendencia a entrar de la célula a través de los poros y esta energía potencial es aprovechada para que otras moléculas, como la glucosa y los aminoácidos, puedan cruzar la membrana en contra de un gradiente de concentración.
Cuando la glucosa cruza la membrana en el mismo sentido que el Na+, el proceso se llama Symporte o cotransporte ; cuando los hacen en sentido contrario, el proceso se llama Antiporte o contratransporte
Transporte Grueso
Algunas sustancias más grandes como polisacáridos, proteínas y otras células cruzan las membranas plasmáticas mediante verios tipos de transporte grueso:
Endocitosis: es el proceso mediante el cual la sustancia es transportada al interior de la célula a través de la membrana. Se conocen tres tipos de endocitosis:
Fagocitosis : en este proceso, la célula crea una proyecciones de la membrana y el citosol llamadas pseudopodos que rodean la partícula sólida. Una vez rodeada, los pseudopodos se fusionan formando una vesícula alrededor de la partícula llamada vesícula fagocítica o fagosoma.
El material sólido dentro de la vesícula es seguidamente digerido por enzimas liberadas por los lisosomas.
Los glóbulos blancos constituyen el ejemplo más notable de células que fagocitan bacterias y otras sustancias extrañas como mecanismo de defensa
Pinocitosiss: en este proceso, la sustancia a transportar es una gotita o vésicula de líquido extracelular. En este caso, no se forman pseudópodos, sino que la membrana se repliega creando una vesícula pinocítica.
Una vez que el contenido de la vesícula ha sido procesado, la membrana de la vesicula vuelve a la superficie de la célula.
De esta forma hay un tráfico constante de membranas entre la superficie de la célula y su interior.
Endocitosis mediante un receptor : este es un proceso similar a la pinocitosis, con la salvedad que la invaginación de la membrana sólo tiene lugar cuando una determinada molécula, llamada ligando, se une al receptor existente en la membrana.
Una vez formada la vesícula endocítica está se une a otras vesículas para formar una estructura mayor llamada endosoma.
Dentro del endosoma se produce la separación del ligando y del receptor: Los receptores son separados y devueltos a la membrana, mientras que el ligando se fusiona con un liposoma siendo digerido por las enzimas de este último.
Aunque este mecanismo es muy específico, a veces moléculas extrañas utilizan los receptores para penetrar en el interior de la célula. Así, el virus del Sida entra en las células de los niéndose a unas glicoproteínas llamadas CD4 que están presentes en la membrana de los mismos
Las vesículas endocíticas se originan en dos áreas específicas de la membrana:
Los "hoyos recubiertos" ("coated pits") son invaginaciones de la membrana donde se encuentran los receptores
Los cavéolosson invaginaciones tapizadas por una proteína especializada llamada caveolina, y parece que juegan diversos papeles:
La superficie de los cavéolos disponen de receptores que pueden concentrar sustancias del medio extracelular
Se utilizan para transportar material desde el exterior de la célula hasta el interior mediante un proceso llamado transcitosis. Esto ocurre, por ejemplo, en las células planas endoteliales que tapizan los capilares sanguíneos.
Están implicados en el proceso de envío de señales intracelulares: la unión de un ligando a los receptores de los caveólos pone en marcha un mecanismo intracelular de envío de señales
Exocitosis : Durante la exocitosis, la membrana de la vesícula secretora se fusiona con la membrana celular liberando el contenido de la misma. Por este mecanismo las células liberan hormonas (p.ej. la insulina), enzimas (p.ej. las enzimas digestivas) o neurotransmisores imprescindibles para la transmisión nerviosa.
Estos antecedentes nos permiten comprender el porque de la enfermedad cuando el mecanismo se estriopea o altera.
El siguiente trabajo REGULACIÓN DE CANALES IÓNICOS nos aporta mayor información sobre el misterio de los canales iónicos. Este trabajo es de autoria de los siguientes profesionales :
Jefe de Grupo ALVARO VILLARROEL MU-OZ Becario Postdoctorale Fernando Moro Pérez (UE) Becario Predoctorale Eva Yus-Nájera (FIS) Científico Visitante Daniel Thai Dam (BioClever) Personal Técnico Uyen Le (UE) Carmen Page Alonso (UE)
Los canales iónicos son proteínas que forman poros que atraviesan la membrana celular.
Cuando el poro está abierto, ciertos iones pueden pasar a su través, pero otros son excluidos.
De esta manera, podemos hablar de canales de potasio, de sodio, etc., o de canales catiónicos o de canales aniónicos, según el tipo de ión o iones que pueden fluir por su poro.
A su vez, la apertura del poro está controlada por distintos tipos de señales, tales como la diferencia de potencial entre el interior y el exterior de la célula, o señales químicas, o mecánicas.
Así hablamos de canales operados por voltaje, por ligando, o mecanosensibles. Entre los canales iónicos, los selectivos a potasio representan, con diferencia, la categoría más diversa.
Se expresan en todas las células conocidas, y regulan procesos tales como la diferenciación celular, proliferación, secreción o transmisión de señales eléctricas.
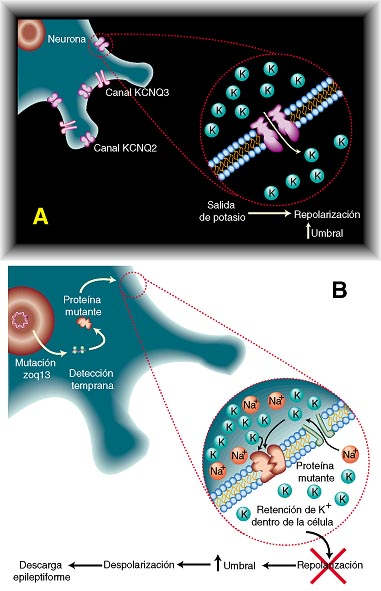
Los canales de potasio dependientes de voltaje KCNQ/(tipo M) ejercen un importante control sobre la excitabilidad neuronal.
Se han identificado mutaciones en los cuatro miembros conocidos de la familia KCNQ que son responsables de ciertas formas hereditarias de epilepsia, de arritmia y de sordera en humanos.
La anomalía hereditaria se relaciona con el tejido donde se expresa la subunidad KCNQ mutada (ej. cerebro, corazón u oído).
La corriente M es el sitio de acción preferente de la linopirdina, una droga que reduce el umbral de inducción de LTP (un fenómeno neuronal relacionado con la formación de la memoria), y facilita el aprendizaje en animales de experimentación.
Esto sugiere que la supresión de la corriente M a voluntad puede ser útil en el tratamiento de la enfermedad de Alzheimer.
La corriente M toma su nombre porque es inhibida por la estimulación de receptores muscarínicos de acetilcolina.
Aunque ha sido objeto de intenso estudio durante más de 20 años, las bases fisiológicas y moleculares de la regulación del canal M son en su mayor parte desconocidas.
Nuestra investigación se centra en el estudio de la regulación de los canales M por interacciones de tipo proteína-proteína combinando aproximaciones moleculares, farmacológicas y biofísicas.
Pensamos que la comprensión molecular de la regulación de estos canales puede sentar las bases para el diseño racional de una nueva generación de fármacos útiles en el tratamiento de enfermedades cardiacas o neurológicas.
Informes científicos
Nuestro trabajo se centra alrededor de la idea general de que el aumento de la corriente M puede ayudar en el tratamiento de la epilepsia (aunque su causa sea ajena a los canales KCNQ), mientras que la reducción de esta corriente puede ser útil para el tratamiento de la enfermedad de Alzheimer.
Cada etapa en el proceso de regulación de estos canales es, por tanto, una diana adecuada para el desarrollo de fármacos potencialmente útiles en el tratamiento de enfermedades neurológicas.
Con nuestra investigación intentamos responder, entre otras, las siguientes preguntas:
¿Cuál es la distribución de las subunidades KCNQ en el cerebro humano?
Para ello estamos desarrollando antisuero contra regiones divergentes de las subunidades neuronales KCNQ.
Este antisuero será empleado para localizar inmunocitoquímicamente estos canales al microscopio lumínico y electrónico. Esta información será útil en la interpretación del papel de la corriente M en LTP/LTD.
¿Cuál es la base molecular del ensamblaje diferencial de los canales KCNQ?
La observación de que las convulsiones en BNFC hereditaria debidas a mutaciones en KCNQ2 o KCNQ3 sólo tienen lugar en infantes sugiere la existencia de mecanismos compensatorios durante el desarrollo.
En cerebro de ratón, las subunidades KCNQ2 se expresan desde el día postnatal 3 (P3), alcanzando un nivel estable a P7, mientras que KCNQ3 está presente a niveles bajos en P3, pero su expresión aumenta continuamente hasta la madurez.
Si bien las subunidades KCNQ3 apenas forman canales funcionales por sí solas, potencian más de 15 veces la corriente cuando se combinan con subunidades KCNQ2.
La bases molecular y las consecuencias funcionales de esta interacción son desconocidas, aunque estas observaciones sugieren que puede jugar un papel importante en la desaparición de ciertas epilepsias hereditarias en adultos.
Nuestra comprensión de este fenómeno permitiría el desarrollo racional de fármacos reguladores de la corriente M.
Para alcanzar este objetivo, nos basamos en la observación de que la subunidad KCNQ3 se asocia indistintamente con las subunidades KCNQ2 o KCNQ4, pero estas últimas no se ensamblan entre ellas.
El objetivo es identificar, creando canales quiméricos, la región mínima de KCNQ3 que permita que el canal KCNQ2 se pueda ensamblar con KCNQ4, o potenciar a los canales KCNQ2 salvajes.
¿Cuál es el papel de las proteínas de bajo peso molecular en la regulación de los canales KCNQ?
Se lleva ya más de 20 años buscando el segundo mensajero implicado en la regulación de la corriente M. Todos los sistemas que producen inhibición de la corriente M activan a la fosfolipasa C, con la consecuente activación de la PKC y la liberación de calcio intracelular, pero ninguno de estos efectores da cuenta por completo de la regulación de la corriente M.
Al igual que la corriente M, el canal Kv1.2 es regulado por muscarina a través de una cascada en la que participa una proteína G insensible a la toxina pertúsica.
Ambos tipos de canales son también regulados por quinasas de tirosinas. En el caso de Kv1.2 se ha demostrado la participación de proteínas G de bajo peso molecular en la regulación de los canales Kv1.2. La similitud en ciertos aspectos de la regulación de los canales KCNQ y Kv1.2 sugiere la posibilidad de que estas proteínas estén también implicadas en la regulación de los canales KCNQ.
¿Qué papel juegan las proteínas reguladoras de proteínas G (RGS) en la modulación de los canales KCNQ?
El proceso de señalización mediado por segundos mensajeros se inicia a menudo con la activación de proteínas G.
Estas proteínas al ser estimuladas unen GTP permitiendo la activación de otros componentes de la cascada de señalización.
El ciclo de activación se para cuando el GTP se hidroliza a GDP. Existe una familia de proteínas RGS (se conocen más de 20 en la actualidad) que regula esta actividad GTPásica de las proteínas G. Nuestro objetivo es identificar cual o cuales de estas proteínas RGS están implicadas en la regulación de los canales KCNQ.
¿Interaccionan los canales KCNQ neuronales con otras proteínas? ¿Cuáles son las consecuencias funcionales de estas interacciones?
Está establecido que, casi sin excepción, la subunidad formadora del poro de los canales interacciona con subunidades accesorias, con quinasas de proteínas o con el citoesqueleto.
La observación de que la subunidad cardiaca KCNQ1 interacciona con la subunidad accesoria miniK sugiere la existencia en el cerebro de proteínas con función análoga.
La baja densidad y la carencia de ligandos apropiados dificulta enormemente la purificación bioquímica de los canales KCNQ. El sistema de doble híbrido de levaduras representa una alternativa viable para la realización de estos estudios.
Este último trabajo se encuentra basado en :
Martinez-Padrón M. y Villarroel A. (1998) Canales iónicos dependientes de voltaje y de ligando Fundamentos de Neurociencia, chapter 6 155-180
Villarroel A., Regalado M. P. and Lerma J. (1998) Glycine-independent NMDA receptor desensitization: Localization of structural determinants. Neuron 20: 329-339
Olmos G., DeGregorio-Rocasolano N., Regalado M.P., Gasull T., Boronat M.A., Trullas R., Villarroel A., Lerma J. and García-Sevilla J.A. (1999) Protection by imidazol(ine) drugs and agmantine of glutamate-induced neurotoxicity in cultured cerebellar granule cells through blockade of NMDA receptor. Br. J. Pharmacol. 127: 1317-1326
Fayyazuddin A., Villarroel A., LeGoff A., Lerma J. and Neyton J. (2000) Four residues of the extracellular N-terminal domain of the NR2A subunit control high-affinity Zn binding to NMDA receptors. Neuron 25: (683-694)
Colaboraciones
Brown, D.A., University College London, UK
Jentsch, T.J., ZMN/Universität Hamburg, Germany
Storm, J., University of Oslo, Norway
Ferrer-Montiel, A., Universidad Miguel Hernández, Alicante
Cachero, T., Biogen, Massachusetts, EEUU
DiverDrugs, Barcelona
NeuroSearch, Denmark
Fuentes de financiación
Acción Especial CSIC
Unión Europea (QLG3-1999-00827)
2.- ) "CONDUCTORES BIOLÓGICOS": Material extractado de una publicación de la Dra.Gloria Riquelme
PROTEÍNAS CONDUCTORAS DE ELECTRICIDAD Y "CANALOPATÍAS"
ENFERMEDADES ASOCIADAS A SU FUNCIONAMIENTO DEFECTUOSO.
La canalopatología no es sólo una nueva palabra que cada día está más presente en el lenguaje científico y médico, sino una nueva rama de la Fisiopatología, área cuyo objetivo es el estudio de los mecanismos y causas de las enfermedades.
Con el avance vertiginoso de los últimos 20 años en biología molecular, fisiología, genética, etc. y en la tecnología, es muy factible que el conocimiento del hombre acerca de las enfermedades y la precisión de sus causas aumente en forma exponencial.
Este incremento implicará necesariamente que los nuevos vocablos del lenguaje, asociados a recientes descubrimientos, se extenderán a un público general que, habiendo asumido la responsabilidad de su salud, necesita entenderlos de una forma simple.
Un desafío constante para los científicos es transmitir los hallazgos al público, encantarlos y conquistarlos en su significado y proyección a su calidad de vida cotidiana.
En esa línea trataré de contar de qué se trata este tema. Las Canalopatías describen el conjunto de enfermedades asociadas a defectos en el funcionamiento de una clase de proteínas que genéricamente se llaman "canales iónicos ".
¿ Qué son los canales iónicos? Son proteínas integrales que están en las membranas celulares y cuya función es ser vía de paso de moléculas con carga eléctrica (iones sodio, potasio, calcio, etc.), es decir son conductores biológicos de electricidad.
Las membranas celulares separan el medio intracelular del extracelular y también los compartimentos intracelulares entre sí, de modo que necesitan variados mecanismos para establecer comunicaciones entre los sectores que segregan.
Entre estos mecanismos son muy importantes aquellos responsables del transporte de solutos orgánicos e inorgánicos, agua y nutrientes en general.
La membrana celular estructuralmente está compuesta de una doble capa de lípidos que es impermeable al paso de moléculas cargadas, por ello este proceso es mediado por proteínas especializadas en transportar, entre ellas están las conocidas como canales iónicos.
Los canales iónicos tienen la capacidad de conducir millones de iones por unidad de tiempo y subyacen las corrientes iónicas involucradas en muchos procesos biológicos, además tiene la capacidad de seleccionar el tipo de ion que transportan, por un sistema más complejo que la simple selección por tamaño.
La tercera característica es la capacidad de responder a señales muy específicas que pueden ser químicas, mecánicas o eléctricas, lo que es determinante en el rol que estas proteínas conductoras juegan en fisiología.
Estos canales iónicos se encuentran en las membranas de todos los animales y participan en diferentes procesos, como por ejemplo, la transmisión del impulso nervioso, la contracción muscular, la regulación de volumen celular, la proliferación celular, aprendizaje y memoria etc.
Por lo anterior, es natural que haya un aumento creciente de enfermedades humanas y animales cuya causa sea un defecto funcional de un canal iónico, pues tales alteraciones pueden tener profundos efectos para el individuo.
El desafío de parte de la ciencia actual es entender los canales iónicos y las bases moleculares de las canalopatías.
Esto implica conocer de todas las áreas involucradas, desde la genética, la biología molecular, la biofísica, entre otras, hasta el rol fisiológico de las mismas, esto no es fácil, de modo que la ciencia de hoy se enfrenta a la tarea en equipos multi disciplinarios que permitan la caracterización del comportamiento normal, la correlación entre la estructura y la función y la identificación de los "desórdenes" de los canales iónicos "enfermos".
Las enfermedades asociadas a canales iónicos pueden ocurrir por diferentes razones.
Por ejemplo: a) por mutaciones cuyo resultado sea que se "pierde " la proteína o que es defectuosa,
b) la proteína podría estar "sana", pero el sistema que la regula ser el anómalo o
c) todo el sistema puede estar "sano", pero los canales son blanco de una amplia gama de toxinas que alteran su funcionalidad.
Un caso familiar de este último tipo de disfunción es el que ocurre con las llamadas neurotoxinas de la marea roja. Una de ellas es la saxitoxina ( STX) que afecta un tipo de canales iónicos del sistema nervioso, estos canales de sodio (porque conducen iones sodio) están involucrados en la transmisión del impulso nervioso y por lo tanto su falla puede causar la muerte. La STX impide que el canal conduzca, es decir "bloquea" el paso de corriente produciendo una disfunción.
La mayoría de las enfermedades que se han descrito como canalopatías son mutaciones genéticas. Por ejemplo, la fibrosis quística, enfermedad genética que afecta especialmente a los caucásicos, recesiva asintomática para los heterocigotos, pero de baja sobreviviencia en los homocigotos.
Esta enfermedad se debe a defectos funcionales de los canales de cloruro presentes en intestino, páncreas, glándulas salivales, etc.
Otras enfermedades son debido a alteraciones de canales de sodio o potasio en sistema nerviosos (ej. epilepsias con cuadros febriles, episodios atáxicos, etc.) , músculos (ej. Miotonías) incluyendo al músculo cardiaco (ej.arritmias), la lista suma y sigue incrementándose día a día.
Sin embargo, hay un conjunto de ellas en que el defecto de su regulación puede causar la enfermedad, ya que los canales también están sujetos a efectos de moduladores o reguladores - correspondiente a una amplia gama de elementos tales como calcio, hormonas, ácidos grasos, neurotrasmisores, etc. - que pueden modificar la función del canal.
Ejemplo de esto, son algunas diabetes juveniles en las cuales hay una regulación anómala de los canales de potasio (conducen potasio) de las células pancreáticas.
¿ Por qué ahora y no antes se descubrieron estas causales de enfermedades?
En las ciencias experimentales la introducción de nuevas tecnologías tiene un rápido impacto en el crecimiento del campo y en caso de los canales iónicos es algo que se cumple a cabalidad.
En los últimos 10 años un gran número de canales se han descrito en todos los tejidos gracias a las facilidades que ha dado el desarrollo de la electrofisiología y de la biología molecular que ha permitido hacer un correlato estructura - función.
La forma directa de estudiar esta proteína conductora, registrando la corriente que pasa por una molécula, fue el gran aporte de Neher y Sackmann, un físico y un médico quienes dieron el gran salto de medir corrientes "in situ" del orden 10-12 amperes, correspondiente a la corriente que pasa por un canal abierto, corrientes varios órdenes de magnitud más pequeñas que las corrientes cotidianas de sus equipos eléctricos del hogar.
Estos científicos alemanes en 1991 recibieron el Premio Nobel por el desarrollo de la metodología llamada patch-clamp.
¿ Cuál es el futuro y hacia donde vamos?
Difícil predecir qué pasará mañana, pero sin duda que el avance de la ciencia consolidará el conocimiento de los mecanismos básicos de las enfermedades en profundidad y por lo tanto, el conocimiento de la curación de las mismas.
Fantástico desafío, para los que trabajamos en el área, es seguir caminando por la ruta de la " fisiología molecular " buscando respuestas de cómo funciona lo normal y lo patológico.
En lo particular, mi fascinación es encontrar algunas de esas respuestas en un órgano vital para el desarrollo de una nueva vida, esto es la placenta humana. La placenta es la vía obligada de transporte entre la madre y feto, donde los canales iónicos son uno de los mecanismos implicados en esa tarea.
¿ Qué le puedo decir a Ud., lector de estas líneas, sobre el significado y el impacto del conocimiento en su vida?
Creo no equivocarme al decir que se traducirá en beneficios no sólo para curar, sino para prevenir.
Por ejemplo, se podría acceder a un test de diagnóstico rápido que pudiese retardar el daño y prevenir secuelas, por otro lado permitir un mejor manejo clínico de la terapia y por ultimo, aunque parezca ciencia-ficción, puede permitir la reparación, el reemplazo o la incorporación del canal funcionalmente defectuoso, es decir la terapia génica está ad portas
Este analisis cientifico nos explica la importancia de la normalización electrolítica como terapia prevalente en la recuperación biológica. Esta es la mas importante actividad clínica dentro de la Medicina Biológica.
3.-) Conductancias Iónicas ( Biofísica )
1. Historia
En el verano de 1947 Hodgkin escribió a Cole contándole que junto con Katz (1949) habían encontrado que el responsable de la despolarización y el sobretiro del potencial de acción del axón gigante del calamar era el sodio.
Para esto, tan pronto como pudieron después de la Segunda Guerra Mundial, Hodgkin había viajado con Katz a Plymouth, donde hicieron experimentos que mostraron que el potencial de acción era proporcional al logaritmo de la concentración externa de sodio, incluso para soluciones hiperosmóticas.
Interpretaron sus datos experimentales de acuerdo con la ecuación de Goldman (1943), obteniendo un aumento transitorio de la permeabilidad en reposo para el sodio, relativa a la del potasio y cloruro, que pasaba de (PK:PNa:PCl = 1.0:0.04:0.45) a (PK:PNa:PCl=1.0:20:0.45), para después del máximo del potencial de acción regresar a (PK:PNa:PCl=1.8:0:0.45).
Asi, antes de 1948, Hodgkin, Huxley y Katz tenían una idea clara del significado de la permeabilidad transitoria al sodio durante el impulso, así como ideas sobre sus fases de despolarización y repolarización; aparentemente lo único que les faltaba era como avanzar en ese problema sin el control de voltaje.
En un simposium en Paris Hodgkin, Huxley y Katz (1949) dieron detalles de su equipo experimental y presentaron suficientes resultados para mostrar que estaban seguros de adonde querían llegar. Sin embargo, habían desarrollado un sistema de transportador para el sodio, que requería la aparición inmediata de una corriente de sodio, que después decaería más o menos exponencialmente y sería inactivada tal vez por el calcio.
Eventualmente Hodgkin y Huxley abandonaron esa hipótesis y en el Congreso de Fisiología en Copenhagen, en el verano de 1950, mostraron a Cole sus datos sobre las conductancias al sodio y potasio analizadas como funciones del tiempo y potencial. Así, el Journal of Physiology indica que sus primeros cuatro trabajos fueron recibidos el 24 de octubre de 1951 y el quinto trabajo el 10 de marzo de 1952, lo que indica que tuvieron solamente dos estaciones de calamares en Plymouth y cuatro años de tiempo para hacer el trabajo.
2. El potencial de acción
Cuando se aplica un pulso pequeño de corriente de salida a un axón, la disminución en la carga del capacitor difunde longitudinalmente.
Después de un pulso mayor, el sistema control del Na+ se abre un poco para permitir alguna entrada de sodio y este potencial difunde solamente una distancia longitudinal corta antes de ser controlado por la respuesta lenta del sistema control del K+.
Un pulso más grande que aumente el potencial por unos 20 mV, hace que el sistema control del Na+ permita más corriente de entrada, la que no solamente aumentará el potencial sino que difundirá interna y externamente a lo largo del axón para llevar las áreas más cercanas al potencial al que aparecerá una corriente neta de entrada.
Entonces, al igual que en el sitio de estimulación, el sistema control del Na+ responderá para dar una gNa más rápida y grande, y se inicia el curso completo de la excitación.
Conforme el potencial se dirige hacia la respuesta completa, también manda una cantidad mayor de corriente de entrada más y más lejos en el axón, para llevar la actividad primero a los puntos cercanos y después a los lejanos.
Asintóticamente el proceso se convierte en un impulso con velocidad constante, autosostenido.
Cuando un impulso se aproxima a una velocidad de cerca de 20 m/seg, el potencial de la membrana se desplaza hacia cero y empieza a abrirse una compuerta que permite el paso del Na+.
Conforme unos iones entran bajo la fuerza tanto del campo eléctrico como del gradiente de concentración, empiezan a neutralizar el exceso en la concentración interna de iones negativos y ayudan a llevar el potencial hacia cero.
A su vez, este cambio de potencial aumenta rápidamente la entrada de iones Na+, lo que resulta en un proceso autorregenerativo que lleva el potencial más allá del potencial cero.
Después, conforme aparece un exceso interno de cargas positivas, la fuerza que lleva los Na+ hacia dentro se pierde y el potencial se invierte, con lo que la fuerza hacía dentro es reemplazada por una oposición que retrasa la entrada de Na+, ya que ahora se acerca a un nuevo equilibrio alrededor de +50 mV, el ENa.
Durante las últimas etapas de este proceso, la vía para el sodio lentamente empieza a presentar más dificultades, además que para entonces se permite el paso del K+ más libremente, lo que resulta en un máximo para el potencial.
Conforme el flujo de Na+ se detiene, ocurre una recuperación más lenta debido a la salida de iones K+, que alcanza un máximo alrededor del potencial cero.
Esta velocidad de declinación ocurre en parte debido a que de nuevo hay un exceso de iones negativos en el interior y a la reducción en la facilidad del movimiento de K+ al valor mínimo con el que empezó.
Así, el impulso es solamente una ganancia rápida de Na+ seguida de una pérdida más lenta de K+, lo que obviamente no puede continuar indefinidamente sin otro proceso metabólico, diferente y mucho más lento, que bombea el Na+ extra y lo reemplaza con K+.
3. El Control de Voltaje
La serie de trabajos por Hodgkin, Huxley y Katz (1952) y por Hodgkin y Huxley (1952a-d) es de importancia trascendental para el desarrollo de nuestra ideas sobre la excitabilidad de la membrana.
Esos trabajos proporcionan información obtenida con la técnica del control de voltaje, que no había estado accesible por ningún otro método experimental y además, como están basados en ideas desarrolladas por muchos investigadores en años previos, reúnen todo lo que sabía hasta entonces sobre el proceso de la excitación que da origen al potencial de acción.
Estas ideas fueron tan completamente sintetizadas, que ahora solamente es necesario describir su punto de vista y todos los principios básicos estarán incluidos.
La hipótesis que Hodgkin y Huxley se propusieron probar era la siguiente: la membrana tiene canales que permiten el paso de iones en la dirección que determine su potencial electroquímico.
Este movimiento iónico produce corrientes eléctricas y produce el cambio conocido como 'potencial de acción,' que se debe a un aumento en la conductancia al ion sodio (gNa) que le permite entrar a la célula haciendo positivo el interior, lo que a su vez aumenta la gNa aún más.
Esa conductancia también cambia como función del tiempo y empieza a disminuir aproximadamente hacia el máximo del potencial de acción, por lo que gNa = f(t,V).
Simultáneamente, la conductancia a los iones potasio también está cambiando como función del potencial y del tiempo y, por lo tanto, gK = f(t,V). Así, el problema a resolver era: ¿cuál es la función del tiempo y del voltaje que describe las conductancias gNa y gK?
En ese proceso hay tres variables dependientes del tiempo (gNa, gK y V) que interactúan entre sí y, para hacer el problenma más complicado, todo el proceso de cambios en el potencial se desarrolla a una gran velocidad, con un cambio máximo de aproximadamente 700 V/seg.
Esta serie de eventos fue probada por medio de experimentos hechos con la técnica del control de voltaje, usando el siguiente paradigma experimental:
Cambiar el potencial transmembrana en pasos, lo que requiere trabajar con un área de membrana que llene dos requisitos:
a) isopotencialidad en la región de la que se registre la corriente (control de espacio), y;
b) control instantáneo del potencial por medio de un circuito electrónico de retroalimentación (control de voltaje).
El cambio brusco en el potencial de membrana produce un aumento en la conductancia, lo que induce el movimiento de iones y, como consecuencia, la generación de corriente eléctrica. Entonces, para mantener constante el potencial transmembrana el circuito electrónico proporciona, o retira, una corriente que es igual pero de signo contrario a la que se produce por el movimiento iónico.
La corriente de membrana tiene que ser separada en sus tres componentes
Im = IK + INa + IL
A partir de sus componentes individuales y aplicando la ley de Ohm, calcular las conductancias individuales.
Esto es posible porque los otros parámetros de las ecuaciones son conocidos, ya que el voltaje transmembrana (Vm) es determinado por el circuito electrónico y los potenciales de equilibrio de los iones sodio y potasio (ENa y EK) pueden ser medidos.
IK = gK (Vm - EK) INa = gNa (Vm - ENa)
Este es el paso crucial del método, ya que consiste en la medición eléctrica del movimiento iónico y, a partir de éste, el cálculo de las conductancias iónicas.
Reintroducir el potencial transmembrana como una variable, repitiendo los pasos 1-4 para varios niveles de potencial. A partir de esos resultados derivar expresiones matemáticas que relacionen la conductancia con el tiempo y el voltaje transmembrana.
Una prueba de que el procedimiento era adecuado sería calcular un potencial de acción a partir de las expresiones matemáticas empíricas. Si el potencial calculado era parecido y además tenía propiedades como las del verdadero, esto se consideraría como una prueba adecuada de que la hipótesis inicial era correcta.
Los datos experimentales fueron analizados en términos de conductancias iónicas y este concepto es tan atractivo y útil que puede llegar a ser decepcionante, sobre todo si olvidamos que las conductancias fueron expresiones utilizadas para caracterizar el proceso completamente desconocido por el que los iones cruzan las membranas.
Así, esa descripción pasará a la historia como la primera descripción clara, general y suscinta de los problemas de la permeabilidad iónica.
Desde el punto de vista matemático, es impresionante que las conductancias iónicas sean descritas completamente en términos de una condición inicial, una constante de tiempo y un estado estacionario, y que cada una de ellas sea solamente función del potencial de membrana.
Además, esa descripción ha sido extraordinariamente exitosa, lo que parece decir que es cierto que las características iónicas de la membrana están determinadas en forma unívoca por la diferencia de potencial a través de ella.
Así, si las propiedades iónicas están determinadas totalmente por el potencial de membrana, deben ser observadas en forma simple y directa por medio de experimentos en los que el potencial de la membrana sea la variable independiente, lo que quizá sea la razón por la que el control de voltaje resultó más poderoso que lo que se esperaba sobre la base del concepto de estabilidad simple con el que fue desarrollado.
4. Las ecuaciones
Para describir el inicio y la terminación de la conductancia al sodio, así como el inicio de la del potasio, Hodgkin y Huxley (1952) expresaron los resultados obtenidos durante los experimentos con el control de voltaje en términos de tres parámetros sin dimensiones, n, m, h, que varían entre 0 y 1,. Supusieron que cada uno de estos parámetros obedece una cinética de primer orden,
dn/dt = an (n-n) - bn n
donde an es la tasa de cambio hacia delante y bn la tasa de cambio hacia atrás; en condiciones normales serían solamente funciones del potencial de membrana, V.
Para ajustar las ecuaciones a los datos experimentales expresaron la conductancia como,
gK = gK n4 y gNa = gNa m3h
y escogieron las expresiones analíticas de las a's y b's para proporcionar el mejor ajuste al patrón del análisis de Goldman (1945).
En su forma original, para despolarizaciones desde el potencial de reposo, fueron,
an = 0.01(V+10)/(exp((V+10)/10)-1) bn = 0.125 exp (V/80)
am = 0.01(V+25)/(exp((V+25)/10)-1) bm = 4 exp (V/18)
ah = 0.7 exp (V/20) bh = 1/(exp((V+30)/10)+1)
Después estaban las constantes,
gK = 36 mmho/cm2 EK = 12 mV
gNa = 120 mmho/cm2 ENa = -115 mV
y la corriente de fuga, lineal
gL = 0.3 mmho/cm2 EL = -10.6 mV
Las ecuaciones de H-H son expresiones empíricas de los datos obtenidos durante experimentos con el control de voltaje y producen una representación razonable de ellos.
Con esas descripciones de las corrientes iónicas de la membrana como función del potencial de la membrana fue entonces posible regresar y observar la fisiología de un axón en condiciones normales, ya que los factores adicionales son relativamente simples.
La adición de la capacitancia de la membrana completa la descripción de la corriente a través de la membrana
Im = C dV/dt + Ii
Estas corrientes y potenciales fueron llamados "de membrana," aunque el término menos ambiguo de "control de espacio" también ha sido usado.
Sin embargo, en el axón sin electrodos llegamos a una combinación de la ecuación del cable con las corrientes iónicas, que resulta en un potencial de acción propagado,
(1/(re+ri)) (d2V/dx2) = C (dV/dt) + Ii
En principio hay soluciones analíticas a esta ecuación diferencial parcial de tipo parabólico, como aquella en la que se hace la suposición de una velocidad constante de propagación. Así, para
V = f (t - x/Ø)
donde Ø es la velocidad del impulso, la solución da
(1/(Ø^2 (re + ri)) (d2V/dt2) = C (dV/dt) + Ii
que es de nuevo una ecuación diferencial ordinaria para el cable, pero ahora conteniendo el parámetro desconocido Ø.
Además de su uso como expresiones de las corrientes iónicas obtenidas durante experimentos con el control de voltaje, Hodgkin y Huxley interpretaron estos datos como corrientes iónicas de sodio y potasio, con lo que las ecuaciones son una representación formal y completa de la "Teoría del Sodio," reemplazando las descripciones anteriores, comparativamente cualitativas.
Cole (1968) menciona que un título descriptivo más completo del trabajo podría haber sido: "A Theory that a Sodium Ion Permeability, Controlled by the Membrane Potential, is Responsible for the Impulse Excitation and Propagation of the Squid Axon in Its Normal Environment and Under Normal Conditions, with the Hope and Expectation that the Theory Will Apply to Some Other Excitable Cells and Under Some Other Conditions."
La selección de cinética enzimática para las ecuaciones puede haber sido por conveniencia, pero también está basada en la creencia de que podría corresponder a algún mecanismo intrínseco de la membrana; además, H&H presentaron los parámetros n, m y h como probabilidades de que sitios en la membrana puedan ser activados para permitir la recepción y el paso de los iones.
La activación simultánea de cuatro de esos sitios sería necesaria para el paso de iones potasio e, igualmente, se requerirían tres sitios para el paso de iones sodio, pero en este caso también sería necesario desbloquear otro sitio, denominado h, que corresponde a la inactivación.
Ya que el axón de HH separa los componentes del sodio y potasio de las corrientes iónicas, está postulando mecanismos membranales independientes y por tanto podría considerarse un modelo.
Sin embargo, las ecuaciones y el circuito equivalente son expresiones puramente empíricas de los datos experimentales, como las descripciones de dos cajas negras vistas desde el exterior.
Así, al no basarse en hipótesis o modelos de los mecanismos internos de la membrana, no pueden considerarse modelos.
Hodgkin y Huxley (1952d) presentaron como su primer resultado el potencial de acción obtenido en respuesta a un breve estímulo supraumbral, que compararon muy favorablemente con un registro real.
Otro parámetro del potencial de acción real también obtenido por Hodgkin y Huxley fue la velocidad de propagación.
Para esto superaron el problema de obtener soluciones analíticas para la ecuación no-lineal del cable originada por Kelvin y explicaron que era relativamente más fácil resolver la ecuación si el impulso se propagara a una velocidad uniforme; con esta suposición reescribieron la ecuación, que se convirtió en una ecuación diferencial de 2o orden.
Ii + C dV/dt = (1/K) (d2V/dt2)
Por supuesto, esta ecuación es mas simple que la ecuación parcial diferencial, de la que es solamente un caso especial, pero la única base para la velocidad constante de propagación era experimental.
Sin embargo, por medio de ensayos en los que aproximaron paulatinamente la velocidad al valor constante, Hodgkin y Huxley resolvieron la ecuación hasta un poco más allá del valor máximo del potencial de acción; el resto fue calculado del potencial obtenido durante el control de corriente y el resultado añadido al potencial calculado inicialmente.
Posteriormente y aunque no estaban tratando de probar la solución obtenida por Hodgkin y Huxley, Cole y cols (1955) repitieron la solución, esta vez en la computadora SEAC.
Sin embargo, la medición de la velocidad de propagación del potencial de acción obtenido por las ecuaciones tuvo que esperar hasta que fue posible resolver la ecuación diferencial por medio de su transformación a una ecuación de diferencias (Cooley y Dodge, 1966).
4.-) La siguiente publicacion aporta mas información técnica sobre la materia a queiens se interesen en el detalle fino del proceso de intercambio iónico y sus trastornos :
FENOMENOS DE TRANSPORTE DE IONES A TRAVES DE MEMBRANAS BIOLÓGICAS. UNA APROXIMACIÓN TERMODINÁMICA ESTADÍSTICA.
Miguel Angel Méndez Rojas , Departamento de Química y Biología, Universidad de las Américas-Puebla
· INTRODUCCION.
Uno de los tres principales procesos celulares que consumen energía, es el transporte activo, que se define como el movimiento de moléculas polares o iones a través de una membrana, en contra de un gradiente de concentración y en donde el sistema aumenta su energía.
Las membranas biológicas tienen la particularidad química de tener un núcleo no polar hidrocarbonado, que no permite el paso de moléculas polares.
La célula por una parte proteje así los metabolitos y moléculas polares que contiene en su interior, pero a la vez requiere de un proceso que le permita conseguir del exterior metabolitos y nutrientes polares, en ocasiones en concentraciones muy bajas y que también le permita excretar al exterior moléculas e iones polares.
Para este fin, ha perfeccionado un sistema de transporte específico que puede efectuar el movimiento incluso en contra de gradientes de concentración muy elevados.
Además ayudan a mantener el estado estacionario metabólico, mantener constantes las concentraciones de electrolitos inorgánicos (K+ y Ca2+), a mantener las relaciones osmóticas de la célula y su medio, transmisión de información por el sistema nervioso, la conversión de energía del transporte electrónico en energía química del ATP durante la fosforilación oxidativa y fotosintética, etc.
Haste hace pocos años se disponía de muy poca información fisicoquímica y de las bases moleculares del transporte activo. En la actualidad, nuestro conocimiento del transporte a través de membranas constituye un gran campo de investigación bioquímica que esta en rápido crecimiento.
· Mecanismos Generales del Transporte Iónico
Dos son los mecanismos generales por los que los solutos pueden experimentar un flujo o movimiento a través de una membrana, uno que involucra acarreadores de iónes (proceso mediado) y otro que involucra canáles iónicos.
La membrana se puede considerar como un líquido bidimensional cuyos componentes se hallan virtualmente en constante desplazamiento difusional.
Los huecos desaparecen por difusión de moléculas de fosfolípidos cercanas hacia los huecos energéticamente inestables.
Debido a que las membranas pueden tranportar corriente, es posible medir sus propiedades eléctricas.
Los estudios sobre electrofisiología han mostrado una base para probar los efectos no-lineales causados por mecanismos moléculares.
El aislamiento de secciones de membrana, con unos cuantos canales iónicos de transporte, ha permitido hacer estudios de las condiciones en que se efectúan los procesos, a través de registros de corrientes aplicadas a la sección de membrana.
Se ha observado en algunos casos, que cada vez que el canal conduce un ión hay un incremento repentino en la conductividad del canal.
Así, cambiando las concentraciones del ión que conduce el canal, así como de iones auxiliares, pueden estudiarse los mecanismos por los que el canal se abre para conducir iónes a través de la membrana.
Mediante estudios sistemáticos de este tipo se han podido determinar los procesos moleculares elementales los cuáles gobiernan las propiedades moleculares.
Mediante estas aproximaciones mecanísticas, es posible estudiar tres tipos de procesos de transporte en membranas.
El primero que involucra canáles iónicos simétricos; el segundo proceso de transporte involucra acarreadores moleculares y un tercer problema es la aplicación de un modelo de canales simétricos a un problema de importancia para la fisiología nerviosa (modelo de transporte de Hodgkin y Huxley).
Canales Iónicos Simétricos.
Para un canal simétrico no existe diferencia entre un parámentro cinético del interior con uno del exterior de la membrana. Por ejemplo, un canal puede estar en una gran variedad de estados internos a=1,2, ..., k.
Cada estado transporta un ión de interés a una velocidad intrínseca Wa. El proceso elemental de conducción involucra un canal simple en el estado a y un ión simple, Az, donde z es un entero pequeño positivo o negativo.
En este estudio debe aclararse lo siguiente : (nota de la Academia )
Los canales iónicos dependientes de voltaje son los responsables de la generación de los potenciales de acción en el sistema nervioso.
Los canales iónicos pueden encontrarse en dos estados, uno cerrado (no conductor) que no permite el paso de iones y, otro abierto (conductor) que permite el paso de iones en función de su gradiente electroquímico (de mayor a menor).
A nivel molecular, la transición desde el estado cerrado al estado abierto es un cambio conformacional de la proteína inducido por la energía liberada de la unión de un ligando, o por la aportada por un cambio en el voltaje a través de la membrana plasmática.
A los primeros se les conoce como canales iónicos activados por ligando y, a los segundos, canales iónicos activados por voltaje. Independientemente del estímulo o señal que activa estas moléculas, una vez en el estado abierto permiten el paso de iones (permeación) y, dependiendo del grado de selectividad, pueden subclasificarse como selectivos a cationes o a aniones
. La selectividad iónica puede ser tal que se permita preferente el paso de un ión en particular como el Na+ (canales de sodio), el K+ (canales de potasio) o el Ca2+ (canales de calcio).
Biofísicamente, la actividad macroscópica de un canal se caracteriza por una serie de parámetros que incluyen su dependencia del estímulo (ligando o voltaje), cinética de apertura y cierre, selectividad iónica, y desensibilización a la presencia prolongada del estímulo.
Adviértase que la definición macroscópica se refiere a las propiedades obtenidas de medir simultáneamente el comportamiento o respuesta de una población de canales a un estímulo activador.
Conclusiones.
Por medio de un modelo sencillo es posible construir ecuaciones que nos describan el cambio en la corriente transportada por canales iónicos, así como su comportamiento bajo una serie de condiciones controladas.
La comparación de los modelos con los experimentos determinados por electrofisiología, y su elevada correlación positiva, ha permitido comprender mejor los mecanismos de los procesos moleculares elementales que controlan estas propiedades eléctricas.
El modelaje del comportamiento de canales iónicos simétricos, es importante ya que varios sistemas biológicos importantes tienen un comportamiento de este tipo, como es el caso de la bomba ATP-asa de gran importancia en los procesos energéticos de la célula.
Una mejor comprensión del comportamiento de estos sistemas es de gran interés por sus implicaciones en medicina, en neurofisiología, en biología celular, etc.
BIBLIOGRAFIA.
Keizer, J., Statistical Thermodynamics of Nonequiblibrium Processes, Springer-Verlag New York Inc., 1987, USA.
Palacios A., J., Malanco C., F.L, “Análisis del Proceso de Separación con Membranas como un Fenómeno de Transporte”, Educ. Quim., UNAM, 1993.
Watson, J.D., Molecular Biology of the Gene, 3th. Edition, W.A. Benjamín Inc., 1976, USA.
Lehninger, Bioquímica, Edit. Omega, 1987, México.
5.- ) El siguiente estudio nos va aclrando la situación :
La Neurona Biológica
Antes de comenzar esta sección, cabe mencionar que el estudio teórico del funcionamiento del sistema nervioso se ha limitado al estudio de varias de las especies de seres vivientes, en las que es notoria la especialización dependiendo del hábitat en el que se encuentra y a las actividades que realiza.
Ante esto cabe mencionar que no todos los miembros del Reino Animal poseen cerebro.
En el caso de los invertebrados las células nerviosas tienden a agruparse formando ganglios, éstos ganglios están organizados de una manera típica para la mayoría de los invertebrados: los cuerpos de las células nerviosas están dispuestos alrededor de la superficie externa, mientras que las ramas y las conexiones sinápticas constituyen un neurópilo dentro del núcleo ganglionar.
También las neuronas tienen una forma característica en los invertebrados: cada célula tiene una sola fibra fuerte que da ramas hacia el neurópilo y luego entra en los conectivos o en las comisuras para conectar con otros ganglios o con las raíces nerviosas para inervar la periferia.
En algunos invertebrados se pueden encontrar algunas células grandes y fácilmente reconocibles, las cuales han sido de gran ayuda para los estudios electrofisiológicos.
Estos ganglios tienen una actividad asociada, por ejemplo, en la parte sensorial hay varios tipos de receptores.
Algunos de éstos están especializados para el tacto, el dolor y la presión y constituyen un primitivo sistema somatosensorial para detectar la estimulación de la superficie corporal o de la pared corporal. Hay también receptores para detectar el equilibrio, sustacias químicas y la luz.
Pasando a los vertebrados, es notorio que la evolución tuvo gran influencia para que el cerebro se volviera cada vez más complejo y especializado en las especies más avanzadas pero, al mismo tiempo, conservará todas sus antiguas partes.
Esta falta de cambio radical no debería sorprendernos, puesto que el medio ambiente, que es la base del reino animal, es el mismo para todos.
Lo que hace que el sistema nervioso de una especie sea diferente al de otra es el sitio particular que las especies ocupan en la ecología del mundo y el tamaño y complejidad del cuerpo que el sistema nervioso debe controlar.
A manera de ejemplo, se ve que el tiburón, un pez primitivo cuyos receptores principales son de tipo olfatorio, tiene una enorme proporción de su cerebro dedicada a este proceso sensorial.
Por ello no necesita que sus hemisferios cerebrales estén completos, sino sólo un mesencéfalo bien desarrollado para conducir impulsos entre su aparato olfatorio y los centros motores.
Si ahora se pasa de los peces a los reptiles, se observa que han tenido lugar varios cambios notables en la evolución del cerebro.
El cocodrilo tiene zonas especializadas en el sistema olfatorio menos desarrolladas que el tiburón, probablemente porque realiza menos actividades guiadas por el olfato y más por sus otros sentidos. En los reptiles, los hemisferios cerebrales están poco desarrollados.
En las aves los hemisferios cerebrales son mucho más grandes que en los reptiles, los lóbulos ópticos están bien desarrollados al igual que el cerebro, cuya función es coordinar y controlar las actividades motoras.
Se podría seguir mencionando ejemplos, pero no viene al caso de esta tesis, sólo cabe hacer notar que la cúspide, hablando desde el punto de vista de la complejidad, no puede ser limitada a un tipo de especie, pues esta depende de la actividad desarrollada por el organismo, así como tambien hay que considerar que el grado de "inteligencia" o capacidad de aprendizaje alcanzada por un organismo dado, tiene mucho que ver con la alta capacidad de procesamiento de la información, la cual va de la mano con la alta densidad de neuronas y sinápsis.
Antecedentes
El Sistema Nervioso Central ha sido estudiado por la medicina desde hace siglos, pero su compleja estructura ha sido revelada apenas hace un siglo.
En la segunda mitad del siglo XIX, prevalecían dos escuelas de investigadores de esta rama, la de los reticularistas los cuales argumentaban que el sistema nervioso se encontraba formado por una continua e ininterrumpida red de fibras nerviosas; la otra escuela, la de los neuronistas o neuristas defendían que el sistema nervioso estaba formado por un basto número de simples unidades celulares interconectadas entre sí, las neuronas.
Con el continuo desarrollo de la ciencia, la lucha entre ambas escuelas fue definida por la venida de una nueva técnica, inventada por Camillo Golgi alrededor de 1880, por la coloración de las fibras nerviosas bajo una reacción de dicromato de plata.
Esta técnica fue ingeniosamente aplicada por el doctor español Santiago Ramón y Cajal en 1888, eliminándose la doctrina del reticularismo al descubrirse las pequeñas separaciones o brechas entre las neuronas individuales.
La investigación detallada de la estructura interna de las células nerviosas, especialmente después de la invención del microscopio electrónico hace ya 50 años, ha revelado que todas las neuronas están constituidas por las mismas partes básicas, independientemente del tamaño y forma de la neurona.
La parte central de la célula es llamada cuerpo de la célula o "soma", de la que se proyectan numerosas extensiones en forma de raíz, las "dendritas".
La neurona también está formada por una simple fibra tubular, el "axón", el cual se divide en numerosas ramificaciones.
El tamaño típico del soma es de unos 10 a 80 micrómetros, las dendritas y el axón tienen un diámetro de apenas unos cuantos micrómetros.
El propósito de las dendritas es servir como elementos receptores para las señales provenientes de neuronas adyacentes.
Las dendritas y el soma reciben mensajes de otras células.
La información es procesada y el mensaje resultante, si lo hay, pasa a lo largo del axón a otro conjunto de neuronas, por lo que el propósito del axón es la transmisión de la actividad neuronal generada a otra célula nerviosa o fibra muscular.
Para el caso de las células nerviosas se utiliza el término interneuronal, mientras que para las fibras musculares se emplea el nombre de neurona motora.
Existe un tercer tipo de neuronas, las que reciben la información desde los músculos o de los órganos sensoriales, las cuales son llamadas neuronas receptoras.
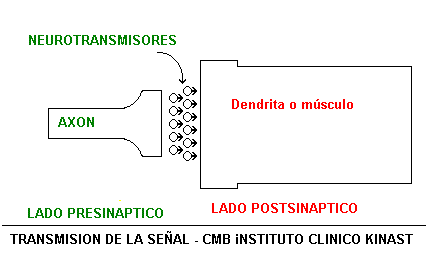
La unión entre el final de una rama del axón, la cuál tiene forma de plato, y otra neurona o músculo es llamada "sinapsis".
Cada sinapsis entre dos células está separada por una pequeña brecha de aproximadamente 200 nanómetros de ancho, dicha brecha es conocida como "brecha sináptica" o "cleft", apenas visible por la técnica de Ramón y Cajal, pero fácilmente revelada por las técnicas modernas.
Existen dos estructuras relacionadas con la sinapsis denominadas "presinapsis" y "postsinapsis" en relación a si se encuentran antes o después de la unión sináptica.
Las sinapsis pueden estar localizadas en cualquier parte del cuerpo de la célula o en las dendritas. La fuerza de la sinapsis generalmente disminuye con el incremento de la distancia, el cual se mide desde el cuerpo de la célula hasta la unión sináptica.
La señal nerviosa es transmitida por medio de una reacción electro-química.
La transmisión eléctrica prevalece en el interior de la neurona, mientras que el mecanismo químico opera entre neuronas, por ejemplo en las sinapsis.
La transmisión eléctrica está basada en una descarga eléctrica que se genera mediante el flujo de iones de sodio (Na+) y potasio (K+), dicha transmisión inicia en el cuerpo de la célula y viaja a lo largo del axón hasta las diversas uniones sinápticas.
En un estado de inactividad en el interior de la neurona, el protoplasma, está cargado negativamente en comparación con el líquido neuronal circundante.
Esta diferencia de potencial, la cual es aproximadamente de -70 milivolts, es soportada por la acción de la membrana celular, la cual separa el fluido intracelular del fluido intersticial que se encuentra envolviendo a la célula, tal y como se muestra en la figura de la estructura de un axón
La membrana es permeable para ciertos iones, con lo cual mantiene la diferencia de potencial entre el fluido intracelular y el fluido extracelular. Este efecto se consigue primordialmente mediante la acción de una bomba de sodio-potasio. También están presentes iones de cloro así como iones orgánicos negativos.
Todos los iones se pueden difundir a través de la membrana, con la excepción de los iones orgánicos, que son demasiado grandes.
Dado que los iones orgánicos no pueden salir de la célula por difusión, su carga negativa neta dificulta la entrada a la célula de iones de cloro por difusión; por lo tanto, habrá una concentración más alta de iones de cloro fuera de la célula.
La bomba de sodio-potasio determina una concentración más alta de potasio dentro de la célula y una concentración más alta de sodio fuera de ella.
La membrana celular es selectivamente más permeable para los iones de potasio que para los iones de sodio.
El gradiente químico del potasio tiende a hacer que los iones de potasio salgan de la célula por difusión, pero la fuerte atracción de los iones orgánicos negativos tiende a mantener adentro el potasio.
El resultado de estas fuerzas opuestas es que se alcanza un equilibrio en el cual hay más iones de sodio y cloro fuera de la célula, y más iones orgánicos y iones de potasio dentro de ella.
Las entradas excitatorias, que llegan a la célula por medio de las dendritas, reducen la diferencia de potencial que existe entre los dos lados de la membrana celular.
La despolarización resultante en el montículo del axón altera la permeabilidad de la membrana celular por efecto de los iones de sodio.
Como resultado, hay un fuerte flujo entrante de iones de sodio positivos, que penetran en la célula, contribuyendo aún más a la despolarización, la cual, al sobrepasar un cierto umbral, tiene como consecuencia generar el potencial de acción.
Entonces la membrana recupera gradualmente sus propiedades originales y regenera su diferencia de potencial en un período de algunos milisegundos.
Durante este período de recuperación, la neurona es incapáz de atender a una nueva excitación, una vez recuperada la neurona, está lista para "disparar" de nuevo.
La velocidad de propagación de la señal de descarga a lo largo de la fibra nerviosa varía enormemente.
En el interior de la célula nerviosa del cerebro humano, la señal viaja a velocidades de aproximadamente 0.5 a 2 m/s, mientras que 2 células cerebrales se comunican entre sí de 20 a 40 m/s, lo cual es aceptable tratándose de una zona local, pero si consideramos la comunicación entre el cerebro y algún miembro periférico, esto toma largos períodos de reacción.
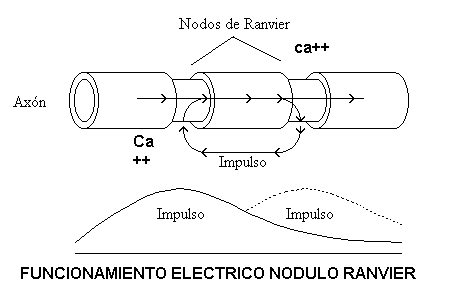
Para incrementar la velocidad de propagación, los axones de las neuronas están compuestos de segmentos individuales, los cuales están cubiertos por una capa de mielina, que es una capa aislante, discontinua en varios puntos, los que son llamados Nodos de Ranvier.
En estos nodos es donde se regenera el impulso. Aquí, los canales de sodio están agrupados entre sí con una densidad de aproximadamente 12,000 canales/mm2 .
En contraste con esto, la membrana mediadora bajo la mielina tiene pocos canales de conductancia dependientes del voltaje, por lo tanto, la propagación a través de los segmentos internodulares es puramente eléctrica
Esta disposición de la membrana es muy efectiva porque la sección envuelta de mielina tiene una alta resistencia y una baja capacitancia que hace que la corriente tienda a fluir a lo largo de la fibra hasta el siguiente nodo, más que a escapar al exterior a través de la membrana.
En realidad, el impulso salta de nodo en nodo, y por lo tanto, esta forma de propagación se denomina conducción saltatoria.
Este es un mecanismo eficiente que consigue una velocidad máxima de conducción (velocidades de transmisión de hasta 100 m/s), con un mínimo de membrana activa, de maquinaria metabólica y de tamaño de la fibra.
También hay que notar que, siendo el impulso de naturaleza eléctrica y que el axón presenta una resistencia y capacitancia asociada de la cual podríamos obtener una analogía a los conductores eléctricos (sin ser real), la señal (impulso), va decreciendo en amplitud a través del tiempo.
Es aquí donde los Nodos de Ranvier, desempeñan un papel de repetidores de la señal, amplificándola en amplitud y retransmitiéndola al siguiente nodo.
La señal de descarga viaja a lo largo del axón hasta la sinapsis, porque no existe un medio de conducción a la siguiente neurona o fibra muscular.
La transmisión de la señal a través de la brecha sináptica es debida más bien a mecanismos químicos y la transmisión eléctrica ocurre sólo en raras ocasiones.
En la transmisión química, cuando la espiga de la señal llega a la terminal nerviosa presináptica, unas sustancias especiales, llamadas neurotransmisores, son liberadas en pequeñas cantidades desde vesículas contenidas en la cara de la terminal presináptica.
El transmisor es liberado por la influencia de iones de calcio (Ca++) en el axón presináptico durante la despolarización causada por la acción de los iones de sodio (Na+).
Las moléculas neurotransmisoras viajan a través de la brecha sináptica hasta la neurona postsináptica en aproximadamente 0.5 ms.
Al llegar los neurotransmisores a unos receptores especiales modifican la conductividad de la membrana postsináptica para ciertos iones tales como sodio, potasio, cloro, etc., los cuales fluyen hacia adentro o hacia afuera de la neurona causando una polarización o despolarización del potencial postsináptico.
Después de esta acción, las moléculas transmisoras son rápidamente rotas por enzimas, las cuales son menos potentes en el cambio de la conductividad iónica de la membrana.
Si el potencial de polarización inducido dU es positivo, la sinapsis es excitatoria porque por influencia de la sinapsis se tiende a activar la neurona postsináptica.
Si dU es negativo, la sinapsis es inhibitoria, contrarrestando la excitación de la neurona.
Las sinapsis inhibitorias terminan en la unión presináptica del axón siguiente, inhibiendo su habilidad de mandar neurotransmisores a través de la brecha sináptica.
En este caso estamos hablando de una inhibición presináptica.
Ante todo esto, surge una pregunta: ¿Bajo qué condiciones es estimulada la neurona postsináptica para activarse o inhibirse?.
En principio, una sinapsis sencilla puede inspirar a una neurona a "disparar" o a "no disparar", esto en realidad es muy raro, especialmente si la sinapsis está localizada en el extremo terminal de una dendrita.
En realidad, cada axón manda sinapsis a las dendritas y a los cuerpos de numerosas neuronas y cada una de estas neuronas están conectadas con otras, de las cuales también reciben sus señales, entonces, el cuerpo de una neurona actúa como un tipo de dispositivo sumador, el cual suma los efectos polarizantes y/o despolarizantes de sus diversas señales de entrada.
Estos efectos decaen con un tiempo característico de 5 a 10 ms, pero varias señales llegan a la misma sinapsis en un mismo período de tiempo, acumulándose estos efectos excitatorios.
Un alto porcentaje de las repeticiones de disparo de una neurona, indica que la señal(es) de entrada fue intensa.
Cuando la magnitud total del potencial de despolarización en el cuerpo de la célula excede el umbral crítico (el cuál es de aproximadamente 10 mv), la neurona dispara.
Entonces, podemos decir que la influencia que tiene una sinapsis depende de varios aspectos, tales como:
La fuerza del efecto despolarizante o peso de la conexión, la localización de la sinapsis con respecto al cuerpo de la célula y el porcentaje de repetición en que llegan las señales a la neurona.
Lo anterior es un tratado que pone en evidencia que la fuerza inherente de una sinapsis no está dada por una sola sinapsis, sino por todas, tal y como lo postuló Donald Hebb:
"Cuando un axón de la célula A está suficientemente próximo para excitar a una célula B o toma parte en su disparo de forma persistente, tiene lugar algún proceso de crecimiento o algún cambio metabólico en una de las células, o en las dos, de tal modo que la eficiencia de A, como una de las células que desencadena el disparo de B, se ve incrementada" [1].
Una sinapsis activa que dispara repetidamente la activación de una neurona postsináptica, puede crecer en fuerza, mientras que otras pueden debilitarse.
Este mecanismo de "plasticidad" sináptica en la estructura de la conectividad neuronal, es conocido como "Regla de Hebb", la cual juega un importante papel en el complejo proceso de aprendizaje.
Bibliografía