ACADEMIA IBEROAMERICANA DE MEDICINA BIOLOGICA Y ODONTOESTOMATOLOGIA | home

Capitulo 25 - Medicina Biológica y Cáncer
COMO CONVIVIR CON EL CANCER - El cáncer desde el punto de vista del enfermo
Yo soy un canceroso mas .
Mis padres y familiares directos todos murieron víctimas del cáncer.
Mi obligación como científico y profesional activo del área clínica es comunicar a quienes padecen de esta maligna enfermedad, la verdad sobre este tema. No mi verdad , sino la de un enfermo y a la vez científico .
Es completamente diferente diagnosticar y tratar a una tercera persona, portadora de un episodio canceroso, que ser tratado como un portador de este mismo mal.
Los cancerosos , como enfermos, necesitamos tener la máxima información a nuestro alcance sobre el tema . Esta información debe ser seria, veraz y de gran lógica para poder entenderla.
Esta información debe sernos entregada en un idioma también a nuestro alcance como enfermo. No todo canceroso entiende el idioma científico y pierde la capacidad de comunicación con su médico.
Esta información nos debe ser suministrada en el nivel cultural que cada uno poseamos como enfermo. Es decir, en un idioma adecuado ,para que pueda ser comprendido en su totalidad.
Jamás se nos debe informar en un idioma extraño como es el de tipo clínico, ya que necesitamos entender claramente el problema que nos aqueja . Si comprendemos el proceso y su gravedad, podemos ayudar en tratamiento y lograr una mejor calidad de vida.
Solamente cuando lo comprendemos en su total magnitud, recién podemos empezar a colaborar y a participar activamente en nuestro tratamiento. Hasta ese instante toda la labor médica no ha servido plenamente sino que parcialmente o nada.
El médico debe comprender, que el riesgo que corremos , al no comprenderlo, nos puede llevar fácilmente a la muerte. Su error en este aspecto puede ser fatal para nosotros. No es lo mismo que en otras enfermedades.
Todo tratamiento y explicación sobre el problema debe ser eminentemente lógico.
Toda solución clínica que nos sea propuesta, debe ser práctica y estar a nuestro total alcance como enfermo.
Es decir , a cada enfermo según sean sus posibilidades biológicas y económicas, se le debe proponer una terapia a su alcance.
No hacerlo es ignorarnos como seres humanos y considerarnos solamente como un medio.
Por eso , pedimos a nuestros médicos tratantes que no desautoricen otras escuelas clínicas sin conocerlas previamente en profundidad. Ello no es solamente simple ignorancia, sino que un grave error de omisión. Existen mecanismos terapéuticos que al complementarlos a las terapias clásicas de mantenimiento de la vida utilizadas en Medicina Clásica, ayudan y potencian éstas.
Ellas pueden ayudar a los enfermos que carecen de mayores recursos para efectuarse quimioterapias, radioterapias y otras técnicas clínicas.
No todos los cancerosos, podemos tener acceso a los mas modernos métodos clásicos de tratamiento y si nos niegan otras opciones, simplemente nos condenan a muerte.
No utilizar todos los métodos disponibles y la más amplia comunicación con el enfermo canceroso, es lo mas parecido a la eutanasia clínica.
Espero que esta ultima y fuerte verdad, nos haga meditar a los clínicos seriamente ,sobre nuestra verdadera relación con el enfermo canceroso. Podemos reducirlo a una pregunta ¿estimado doctor, se la juega usted realmente por nosotros o solamente nos trata imparcialmente ¿
Como canceroso le pido a los médicos, no solamente la seriedad y rigurosidad científica, sino también la comprensión y humanidad que esperamos de nuestro médico. Involúcrese con nosotros de acuerdo al Juramento Hipocrático
Como científicos , los clínicos podemos criticar todo aquello que no esté rigurosamente de acuerdo al método científico occidental. Pero antes de ello se encuentra nuestro Juramento Hipocrático y la Caridad.
No olvidemos jamás que la mano y mente de nuestro médico, es también un instrumento de Dios.
Sabemos que la cura total de los cánceres todavía no está disponible.
Es decir, sabemos que nuestro médico solamente nos puede ayudar a tener una mejor calidad de vida y no a curarnos.
Corresponde al oncólogo tratante, obtener y entregar la exclusiva información que nos debe hacer llegar a cada canceroso, para que podamos entender el problema, su real magnitud y cuales son nuestras reales posibilidades.
Como canceroso, no me interesa defender ninguna teoría en especial o escuela médica en particular, sino solamente esperar la mayor ayuda práctica de mi médico , para lograr la mejor calidad de vida.
Sólo espero su ayuda profesional. El tiempo de vida restante solamente lo entrega Dios. El oncólogo puede ser un instrumento de Dios o simplemente, desperdiciar esa oportunidad.
A esta fecha aún no se ha descubierto el remedio para revertir los cánceres. Pero en cambio, la Ciencia ha permitido mejorar la sobrevivencia de los cancerosos.
Los resultados de hoy son notoriamente superiores a los de hace una década. Podemos seguir avanzando en forma conjunta médicos y enfermos.
Espero que los clínicos y miembros de la comunidad científica lo comprendan, eviten teorizar sobre el tema y dediquen sus mejores esfuerzos prácticos a nuestra calidad de vida.
El objetivo es este documento es esencialmente mantenernos informados sobre el tema , como enfermos y actualizar nuestros conocimientos y en esa forma poder perderle el miedo al cáncer , pero jamas el respeto y en esa forma podremos convivir un mayor tiempo con este mal.
Dios me ha otorgado el privilegio de conocer el problema desde su más profundo interior y en la forma más certera posible. No hay error posible en lo que se siente física y psíquicamente.
Los conceptos sobre electrolitos que incorporo en este documento, si bien constituyen novedad para muchos médicos, son el producto de lo que he visto durante mas de treinta años de profesión y en varios miles de pacientes tanto hospitalarios como en nuestra clínica privada. Sus resultados son espectaculares.
Como un simple ejemplo, en la actualidad se está utilizando con buenos resultados clínicos el producto Helixor ( viscum Album). Este mismo producto se utiliza en medicina herbolaria desde el principio de los tiempos para el control del cáncer. ¿Dónde está hoy la novedad?
Otro ejemplo simple de actualidad. Uno de los últimos descubrimientos para el tratamiento del cáncer cerebral lateral es el uso del sulfato de magnesio. Desde hace siglos se utiliza en medicina popular como un producto para controlar el desarrollo del cáncer y estimular la producción de fibrocitos para encapsular tumores y destruirlos. Su uso en ginecología para erradicar fibromiomas uterinos y nódulos mamarios es clásica desde hace siglos. ¿Quién tiene ahora la razón?
Dado que son observaciones clínicas y no publicaciones científicas los médicos no encontrarán mucha literatura sobre ello.
Pero, alguien inteligente, algún día, investigará estos descubrimientos en particular y en mayor profundidad y publicara sus resultados con estudios de población y un máximo rigor científico.
Yo no dispongo del tiempo para hacerlo, tanto por la enfermedad misma, como por el hecho que prefiero dedicar el tiempo a resolver problemas de los enfermos y no a teorizar. Ya he presentado mas de 150 publicaciones científicas y nueve libros y creo que duermen en las bibliotecas universitarias.
No pretendo con este documento ,convencer a nadie en particular, pero si informar a los enfermos, para que conozcan su realidad y aprendan a exigir lo que realmente corresponde por el servicio médico que pagan.. Pagan un servicio y tienen derecho a resultados adecuados.
Padecer cualquier tipo de enfermedad , cuando se es miembro del equipo de salud, nos permite ser mas objetivos, menos teóricos y poder prevenir para otros y así cumplir la obligación clínica.
La única misión que nos entregó Dios a los Hombres es ser útiles y dar Amor. Así seremos felices. Yo lo soy plenamente.
DR.HORACIO KINAST FELIU
Agosto 2000
CONOZCAMOS MAS SOBRE EL CANCER
El Cáncer, que es una patología que puede ser mortal - si no se trata oportunamente- en realidad es un conjunto de trastornos de diversos tipos y de variados orígenes. Por esta razón debemos hablar de "los cánceres" en lugar del "cancer"
Se conoce como "cánceres " al desarrollo anormal de los tejidos , producido por el crecimiento constante de células anormales que poseen la capacidad de invadir y destruir a otros tejidos, alterando su anatomía y función respectiva.
El cáncer puede originarse a partir de cualquier tipo de célula en cualquier tejido y no constituye una enfermedad única sino que un conjunto de enfermedades que se clasifican en función del tejido y célula de origen.
Existen varios cientos de distintas formas de presentación, siendo tres los principales grandes grupos:
? El primer grupo lo forman los sarcomas, los que proceden del tejido conectivo tales como el hueso, cartílagos, nervios, vasos sanguíneos, músculos y tejido adiposo.
? El segundo grupo son los carcinomas los que proceden de tejidos epiteliales como la piel o de los epitelios que revisten las cavidades y órganos, y los tejidos glandulares de la mama y próstata. Los carcinomas incluyen algunos de los cánceres más frecuentes. Los carcinomas de estructura parecida a la piel se denominan como carcinomas de células escamosas. Los que tienen una estructura glandular se denominan adenocarcinomas.
? En el tercer grupo se encuentran las leucemias y linfomas que incluyen los cánceres de los tejidos formadores de las células sanguíneas. Producen inflamación de los ganglios linfáticos, invasión del bazo y médula ósea, y sobreproducción de células blancas inmaduras. Estos factores ayudan a su clasificación.
CARACTERÍSTICA DE LA ENFERMEDAD CANCEROSA
El crecimiento tumoral canceroso, o neoplasia, es derivado en todas sus células de una célula madre única o clonal
(Clona: Grupo de seres derivados de una misma célula en forma asexuada y que poseen la misma estructura genética.)
Estas células se han escapado al Control o Programa que normalmente rige el crecimiento celular.
Este programa hace que cuando una célula se pone en contacto con la superficie de otra, detiene automáticamente su crecimiento.
La célula cancerosa carece de esta característica y sigue creciendo.
Las células cancerosas son células embrionarias, incapaces de madurar o diferenciarse en un etapa adulta y carentes de capacidad funcional.
La proliferación de estas células puede formar una masa denominada Tumor el que crece sin mantener relación con la función del órgano del que procede.
La estabilidad del sistema y que impide la producción de un cáncer , está regida por el gen P53 en un 50% y en igual porcentaje por el GenBc110 , genes que cuando son desestabilizados activan los oncogenes.
Casi todos los cánceres forman tumores, pero no todos los tumores son cancerosos o malignos; la mayor parte son benignos, lo que significa que no pone la vida en peligro.
Los tumores benignos poseen un crecimiento localizado y suelen estar separados de los tejidos vecinos por una cápsula. Esta cápsula esta formada por fibroblastos - la célula indiferenciada mas abundante de organismo - y puede ser inducida clínicamente a ubicarse en un determinado órgano, gracias a la técnica clínica conocida como sarcode y nosodeterapia (en alemán) o isoterapia ( del francés)
El crecimiento tumoral benigno es lento y mantiene la misma estructura del tejido del cual proceden.
A veces producen alteraciones por obstrucción , compresión o desplazamiento de las estructuras vecinas.
Muchos tumores benignos como los pólipos del cólon se consideran como lesiones precancerosas o cancerizables.
Lesión cancerizable ,es aquella que constituyendo un tejido alterado en sus características biológicas, es benigna, pero estadísticamente en presencia de noxas se transforma en cáncer.
Por esta razón un potencial mecanismo terapéutico es el de encapsular los tumores cancerosos, mediante un aumento de la autoinmunidad . En esa forma es factible disminuir la agresividad del tumor. La característica de encapsular procesos mediante una capa de fibroblastos es una propiedad de efectos defensivos del sistema inmune.
DISEMINACIÓN O METÁSTASIS.
La principal característica del tumor maligno es su capacidad de infiltrar otros tejidos fuera del 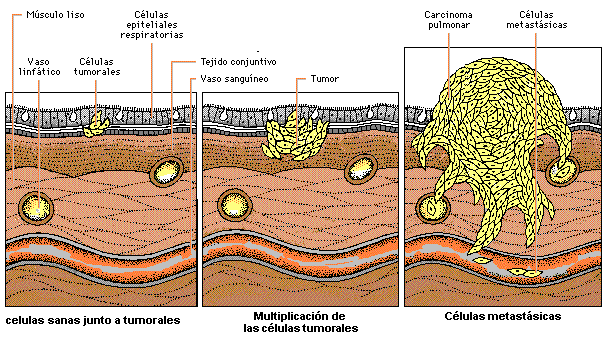 lugar de origen.
lugar de origen.
La invasión de los tejidos vecinos puede producirse por extensión o infiltración, o también a distancia, produciendo crecimiento secundario conocido como metástasis.
La localización y vía de propagación de las metástasis varía en función de los cánceres primarios.
Cuando un cáncer invade la superficie del órgano de origen, las células pueden propagarse desde esta superficie a la cavidad vecina y órganos adyacentes, donde pueden implantarse generando nuevos tumores.
Las células tumorales pueden viajar por el interior de los vasos linfáticos hacia los ganglios linfáticos, o también hacia los vasos sanguíneos. En los vasos sanguíneos, estas células se detienen en el punto en el que los vasos son demasiado estrechos para su diámetro.
Las células procedentes de tumores del tracto gastrointestinal se detienen en el hígado y de allí, posteriormente pueden propagarse a los pulmones.
Las células del resto de los tumores invaden los pulmones antes de propagarse a otros órganos.
Por tanto, los pulmones y el hígado son dos localizaciones frecuentes de metástasis y es por dicha causa que siempre se solicita el examen de dichos órganos en caso de duda diagnóstica.
Muchos cánceres envían sus células a la corriente sanguínea en forma rápida, y mientras algunas de estas células mueren, otras pueden invadir y penetrar en el sistema vascular y en los tejidos.
Si este tejido tiene condiciones favorables para la célula tumoral, ésta se multiplica produciéndose una metástasis.
La condición mas favorable y frecuente para el desarrollo del cáncer, es la presencia de un medio local de tipo ácido ya que en medio alcalino la célula cancerosa difícilmente prospera en su desarrollo.
Es por esta última causa que toda inflamación crónica, la que se caracteriza por ser un medio ácido es una potencial condición cancerizable .
La acidosis tisular o acumulación de ácido en un determinado tejido genera una alteración de la calidad de la matriz extracelular o tejido de sostén, el que tiene normalmente un pH 7.4 y que se conoce con el nombre de Espacio Básico de Pischinger ( nombre de su descubridor en 1975).
Este tejido es un microfiltro molecular de eliminación de toxinas arrastradas por el líquido extracelular. Cuando se acidifica ese medio se produce una polimerización de dicho tejido, el que deja de actuar como filtro y las toxinas productos del metabolismo comienzan a acumularse en el Espacio de Pischinger, hasta saturarlo y luego penetrar al interior de las células, destruyendo su capacidad enzimática hasta modificar su estructura. La fase final de este proceso se denomina también como Cáncer.
En ocasiones, sólo se multiplica un pequeño número de veces produciéndose una acumulación de células que permanecen en forma de micrometástasis.
Esta forma latente puede perdurar varios años, y por muchas razones diferentes puede reactivarse y producir un cáncer recurrente ,motivo por el cual el portador de cualquier tipo de cáncer debe mantener un control permanente con su oncólogo.
Generalmente las células cancerosas conservan las características físicas y biológicas del tejido original a pesar de estar diseminadas. De esta forma, el patólogo puede, a través del examen microscópico de estas células, determinar la procedencia u origen de las metástasis.
Los tumores glandulares pueden ser identificados porque en ocasiones producen de forma indiscriminada la misma hormona producida por el tejido del que proceden.
También responden a las mismas hormonas que controlan esos tejidos en condiciones normales.
Ello explica la conveniencia de un estudio endocrinológico adicional en estos casos y de los minerales que son reguladores del sistema hormonal ,como el magnesio por ejemplo.
Cuanto más agresivo y maligno es un cáncer ,mas se diferencia de la estructura del tejido original, pero la tasa de crecimiento del cáncer depende no sólo del tipo celular y grado de diferenciación, sino también de los factores dependientes del huésped, tales como la estabilidad de su sistema inmunológico y metabolismo.
Una característica de malignidad es la heterogeneidad celular del tumor. Debido a las alteraciones en la proliferación celular, las células cancerosas son más susceptibles de producir mutaciones.
Al evolucionar, el tumor es cada vez menos diferenciado y de crecimiento más rápido. También puede desarrollar resistencia a la quimioterapia o a la radiación.
Solamente cuando el tumor supera el billón de células (1.000.000.000) , se hace aparente y es pesquisable.
CAUSAS MAS HABITUALES DE LOS CÁNCERES
Los factores mas frecuentes que son capaces de provocar un cáncer son :
la herencia,
la toxicidad ácida local
los virus,
las radiaciones ionizantes, los productos químicos
y las alteraciones del sistema inmunológico.
Los investigadores estudian como estos diferentes factores pueden interactuar de una manera multifactorial y secuencial para producir tumores malignos. Los estudios del Prof. Harmut Heine a la fecha son los que mas se aproximan a una explicación razonable.
El cáncer es básicamente, un proceso genético. Las alteraciones genéticas pueden ser heredadas, o producidas en alguna célula por un virus o por una lesión provocada de manera externa. Es así, que el 5% de los cánceres tienen exclusivamente un origen genético.
Aparentemente existe una serie de mutaciones secuenciales que conduce a la malignización de una única célula la que se multiplica como un solo clon.
En un principio se consideró que un clon maligno era algo completamente anormal, y que la única curación posible era la eliminación de todas las células anormales del organismo.
En la actualidad, se sabe que el problema se encuentra en la incapacidad de la célula de poder diferenciarse en su estado adulto y funcional, quizás por la ausencia de algún factor necesario para esa diferenciación.
Clínicamente hemos observado que tanto la disminución del ión magnesio y del ión calcio en los individuos, favorece la aparición y desarrollo de los cánceres y a la vez que la administración de ellos disminuye su velocidad de crecimiento .
Otro importante hecho que debe considerarse en la terapia del paciente canceroso , es conocer que el cuerpo humano funciona óptimamente en un medio neutro ligeramente alcalinizado (PH 7.0 a 7.4) , constituyendo la presencia de un medio ácido, un medio de vida extraño para la célula normal, lo que favorece su deprogramación biológica, desde el punto de vista tanto de la Medicina Biológica como cibernético.
Es importante recordar que cuando existe un cuadro inflamatorio crónico se retiran electrolitos intracelulares alcalinos para modificar el medio acidificado.
Este retiro de elementos intracelulares modifica la estructura interna celular al existir menos elementos indispensables dentro de ella y se altera la calidad de los restantes.
También es de alta importancia considerar que cuando la célula normal se encuentra ante una falta de oxígeno, de inmediato, pierde su capacidad de controlar su propio pH.
El aporte celular de oxígeno suficiente debe estar siempre presente, estimulándose al enfermo canceroso a efectuar ejercicios de respiración nasal, para facilitar la debida oxigenación a nivel celular, favoreciendo con ello el normal proceso metabólico .
Igualmente es positivo el utilizar aparatos que aumenten la capacidad respiratoria nasal (deprogramadores neuromusculares, huinchas adhesivas para mejorar el ingreso de aire nasal ,etc)
Por lo tanto , desde el punto de vista preventivo de la Medicina Biológica, es razonable considerar al cuadro clínico del respirador bucal con antecedentes oncológicos familares, como un potencial paciente cancerizable debido a que genera las condiciones basales para ello.
Esta es una de las importantes razones tanto para el pediatra como para el odontólogo, el considerar como condición grave , la disfunción respiratoria conocida como Respiración Bucal, situación a la cual habitualmente no se le atribuye la importancia debida.
Los profesores de educación física de los colegios también tienen la importante opción de educar al niño en esta materia, estimular su normal metabolismo y disminuir la incidencia de alteraciones metabólicas.
En todos estos casos , de disminución del oxígeno necesario, la glucosa existente a nivel celular sigue actuando y fermenta y el pH baja de 7.35 hasta 6.5.
Los ácidos actúan dañando el ácido ribonucleico quedando destruída con ello , la capacidad de control celular.
El ácido ribonucleico ARN cambia y se producen errores de tipo cromosómico que se agregan al cambio celular y las enzimas intracelulares se vuelven tóxicas y llegan a causar daño letal a la célula.
En pocas palabras, se produce un cambio de una normal oxigenación celular a una fermentación metabólica de alta toxicidad y evidentemente un factor de tipo cancerizable.
Las membranas de las células cancerosas por otra parte no atraen a los elementos alcalinos y se ha demostrado que el interior de la célula cancerosa solamente llega hasta un 1% del calcio de las células normales.
Los iones magnesio y sodio son los que transportan el oxígeno al interior de las células. Cuando están en niveles bajos, se establece una condición cancerizable en personas con antecedentes familiares oncológicos directos.
Igualmente este desequilibrio electrolítico favorece una alteración de los campos magnéticos celulares.
En ausencia de estos cationes o en una cantidad insuficiente es altamente probable que se impida la normal oxigenación celular facilitando la fermentación de la glucosa.
Al elevar el pH a 8,5 - 9 la vida de la célula cancerosa disminuye en pocos días y son eliminadas como células muertas por el sistema inmunológico de tipo fagocitario.
La alcalinización del organismo del paciente canceroso es una de las mayores garantías de supervivencia de éste. Para ello utilizamos sales de tipo alcalinizante.
La Cirugía oncológica y la Radioterapia, actúan exclusivamente a nivel local y lo habitual es que la enfermedad mantenga un cierto grado de diseminación, ya que como sabemos, la apreciación oncológica es posible solamente cuando existe un número superior a un millón de células cancerosas, motivo por el cual se requiere mejorar el sistema inmune , como efecto preventivo.
Ultimamente se ha detectado que las células cancerosas tienden a expulsar los medicamentos contra el cáncer valiéndose para ello de las llamadas bombas aspiradoras de las que se conocen a la fecha ,seis de ellas, aunque se presume la existencia de muchas mas.
Esto hace a veces ineficaz las terapias de tipo oncológico
Otras terapias complementarias en la terapia oncológica :
El ajo protege contra algunos cánceres
Un nuevo estudio parece indicar que el consumo de ajo (allium) es capaz de ejercer un efecto protector contra el desarrollo de cáncer de estómago y de cáncer colorrectal.
Los investigadores que lo llevaron a cabo, pertenecientes a la Universidad de Carolina del Norte, concluyeron que las personas que consumen ajo crudo o cocido en forma regular tienen la mitad del riesgo de sufrir cáncer gástrico, y cerca del 60% menos de riesgo de sufrir cáncer colorrectal, en comparación con quienes consumen poco o nada de este bulbo.
Ahora bien, los beneficios del ajo no se observan con los suplementos de éste y se desconoce el porqué de esta diferencia. Arab y colaboradores revisaron un total de 300 publicaciones científicas sobre cáncer y dieta, analizando los resultados de los 22 estudios considerados como mejor diseñados, relacionados con el consumo de ajo en cualquier parte del mundo.
Algunas investigaciones anteriores afirmaban que el allium tenía la propiedad de proteger a los animales del desarrollo de cáncer, por lo cual muchos científicos creyeron que tal efecto podía llegar a observarse también en los humanos.
Luego del análisis, los autores encontraron que el efecto preventivo del ajo estaba claramente confirmado para el cáncer de estómago y el colorrectal, no así para otras neoplasias de las cuales se disponía de mucha menor información al respecto.
Si bien es probable que en algunos de los estudios analizados habría que profundizar estas afirmaciones, debido a que siempre hay una tendencia a publicar los resultados positivos más que los negativos, las conclusiones son contundentes y los investigadores consideran que el efecto es real.
American Journal of Clinical Nutrition October 6, 2000.
Aspirina podría frenar el Cancer de Próstata
25/09/2000 09:44:38
Según un estudio del Imperial College and Hammersmith Hospital de Londres
Un equipo de científicos del Imperial College and Hammersmith Hospital de Londres ha demostrado un mecanismo de acción por el que Aspirina podría detener el avance del cáncer de próstata, el tipo de cáncer más común en los hombres y el segundo más mortal del mundo.
Según han observado, el fármaco actúa deteniendo la función de una enzima que estimula el crecimiento del tumor y frenando así su avance.
Los científicos del Imperial College and Hammersmith Hospital han estudiado un centenar de muestras de tejido canceroso prostático.
Ello les ha permitido descubrir una presencia de niveles inusualmente altos de una sustancia química, cox-II, en una proporción cuatro veces superior a lo normal, en las células cancerosas.
Esta sustancia actúa estimulando la proliferación de las células cancerígenas. Aspirina, al inhibir la acción de la cox-II, podría frenar el desarrollo del cáncer de próstata.
Debido a que la enfermedad suele afectar a personas de avanzada edad, un control efectivo a largo plazo del crecimiento del tumor podría ser un tratamiento más adecuado, según los científicos, que la cirugía o la radioterapia, más agresivas.
Cada año son diagnosticados más de 16.000 casos de cáncer de próstata, y de ellos sólo 4 de cada 10 sobreviven al cabo de cinco años.
04:59 PM ET 03/16/00 Committee Recommends Cancer Drug WASHINGTON (AP) _ A Food and Drug Administration advisory panel is recommending approval of a drug to be added to first-line treatment for widespread colorectal cancer.
The Oncologic Drug Advisory Committee on Thursday recommended approval for Camptosar injection, made by Pharmacia & Upjohn, in combination with other drugs as a first treatment for patients with colon and rectal cancer.
The FDA is not bound by advisory committee recommendations but usually follows them. Camptosar won FDA approval as a follow-up cancer treatment in 1996.
The committee unanimously recommended the earlier use following reports from clinical trials in which patients who received the drug showed delayed tumor progression and lived longer than those without it.
The drug would be used in combination with two other drugs, fluorouracil and leucovorin. Side effects associated with the drug in clinical trials included diarrhea, nausea and vomiting.
Researchers Say Herbal Formula Offers Relief From Chemotherapy Ills June 16, 2000
COLUMBUS, Ohio (AP) - Cancer patients can significantly and safely reduce the side effects of chemotherapy by taking an herbal formula called Amrit, according to research conducted on the ancient Indian medicine.
"It makes chemotherapy more bearable for patients without interfering in the cancer treatment," said Dr. Hari Sharma, a professor emeritus and former director of cancer prevention and natural products research at Ohio State University.
He and researchers at the All India Institute of Medical Sciences in New Delhi recently completed a study on Amrit and plan to present their findings at the St. Joseph Hospital's Center for Healthy Aging in Chicago on Saturday.
Patients reported Amrit improved their overall well-being during chemotherapy by reducing instances of nausea, vomiting, diarrhea, insomnia, anorexia, and boosting their energy levels.
Several similar drugs are available that - unlike Amrit - have gone through controlled clinical trials and have been approved by the U.S. Food and Drug Administration, said American Cancer Society spokeswoman Joann Schellenbach.
However, she said, any research that can further the understanding of using herbs to treat ailments is encouraged.
"This may be something that proves to be helpful, but with any new substance, we just don't know this early on," she said.
While Amrit has been used for many generations in India as an antidote for healthy aging, little research exists on its medicinal qualities. Sharma acknowledged that the formula has undergone only a few controlled studies and those have been performed over the last 10 years.
Amrit is an antioxidant that contains 44 herbs and minerals, including large amounts of vitamins C and E, as well as beta carotene. Sold by Maharishi Aayurveda Products International, in Colorado Springs, Co., it comes in tablet and paste forms.
Taken together, the herbs increase a chemical in the liver that is responsible for cleansing from the body toxins that cause the side effects, Sharma said.
Dr. Christine Horner-Taylor, a plastic surgeon specializing in breast reconstruction for cancer patients, routinely recommends Amrit to her patients after one had "miraculous" results.
During one round of chemotherapy, Horner-Taylor's patient became incredibly ill, was unable to eat and had no energy. She took Amrit during subsequent rounds and had no side effects.
"She looked just radiant. Most of the time, they look ashen and meek after chemotherapy, but she just was glowing. I had never seen anything like that before," said Horner-Taylor, whose practice is in Edgewood, Ky., across the Ohio River from Cincinnati.
Unfortunately, Horner-Taylor said, many cancer patients don't use Amrit and they remain uncomfortable throughout chemotherapy because most doctors are leery about alternative medicine.
But she said she hopes research like Sharma's will give doctors the proof they need that herbs can work to treat ailm
Researchers Find Cancer-Fighting Chemical In Hazelnuts March 29, 2000
SAN FRANCISCO (AP) - Researchers say they've found the active ingredient of Taxol in hazelnuts, a discovery that could lead to new ways to make the cancer-fighting drug.
"This is potentially good news for cancer patients," said Angela Hoffman, a member of the research team at the University of Portland in Oregon, who was to present the study Wednesday at the national meeting of the American Chemical Society.
The finding may be of interest to competitors of Bristol-Myers Squibb, which holds the exclusive license to make Taxol. Worldwide sales of Taxol brought the company $ 1.5 billion last year, 7.3 percent of its total sales. The drug is now made using chemicals from yew tree needles.
One thing is clear: Eating hazelnuts has no cancer-prevention or cancer-fighting benefits.
"Won't do any good at all, because Taxol is not active orally," said Robert Holton, a Florida State University chemist who gets royalties from Bristol-Myers for the method he developed of synthesizing the drug.
However, having a new source of the active ingredient, paclitaxel, is compelling, said Steve Tighe, senior pharmaceutical analyst at Merrill Lynch. He said much more information is needed before anyone can say if it can be used against cancer.
It took nearly 30 years after paclitaxel was found in yew trees to get Taxol on the market. The latest discovery is still in the lab.
Many questions remain unanswered. Is it economical or even possible to extract paclitaxel from hazelnuts commercially? Will regulators approve it? How many companies would get the license to do it?
Gram for gram, hazelnuts carry just one-tenth of the chemical that yew trees do, researchers said.
"I'm not sure I see what the advantage of the hazelnut over the yew tree would be," said oncologist Clifford Hudis, chief of the Breast Cancer Medicine Service at Memorial Sloan-Kettering Cancer Center.
Taxol and the yew needles used to make it are not in short supply.
Controversy surrounded the drug when the Food and Drug Administration first approved it in late 1992 because Pacific yew trees, its only known source, were being cut down to make it.
But Bristol-Myers quickly found a synthetic production method that starts with the needles of European and Asian yews. No trees die and the needles are plentiful. "By the gazillions, and they grow back," said Holton.
The Oregon researchers found paclitaxel in hazelnut trees while looking for a compound that makes some trees resistant to a fatal plant disease called Eastern Filbert Blight. They isolated the chemical from nuts, branches and shells.
Bristol-Myers goes to trial in May in New Jersey to defend its patent against nine pharmaceutical companies seeking to market generic versions of Taxol. The company did not return calls requesting comment Tuesday.
|

El 90% de los tumores de Cancer de Mama tiene curacion
19/09/2000 09:07:20
La autoexploración mamaria y las nuevas técnicas incrementan las posibilidades de supervivencia.
“Los tumores del cáncer de mama de menos de un centímetro no presentan recurrencias de ser detectados y tratados a tiempo” afirma la Dra. Patricia Kelly, Genetista afiliada al hospital Catholic Healthcare West, de San Francisco.
La Dra. Patricia Kelly explica que, “La detección y tratamiento temprano de tumores de menos de 1 cm, aumenta la expectativa de vida en un 90% en los siguientes 16 años”.
Este porcentaje destaca la importancia de la participación activa de las mujeres en la detección temprana del cáncer de seno.
La autoexploración mamaria, y las nuevas tecnologías desarrolladas para la detección del cáncer de mama, incrementan las probabilidades de supervivencia de las mujeres afectadas por esta enfermedad.
Diagnóstico Precoz
El cáncer de mama es una enfermedad que toma a muchas mujeres por sorpresa debido a que en su etapa más temprana, no causa ningún dolor.
Sin embargo, estas pueden ayudar a detectar precozmente este tipo de cáncer si se realizan oportunamente una autoexploración mamaria, examen que la mujer realiza en sus senos para detectar cualquier cambio que estos pudieran presentar.
La autoexploración mamaria se realiza en cuatro etapas:
1. La mujer debe observar sus senos frente a un espejo para localizar cambios de tamaño. Debe asegurarse que los pezones no estén invertidos o presenten algún tipo de descarga.
2. En segundo lugar, se entrelazan las manos detrás de la cabeza empujándola con estas. Esta posición hace que cualquier anormalidad existente en los senos se haga más notoria. Se deben buscar cambios en la forma y contorno de los pechos, especialmente en su parte más baja.
3. El tercer paso consiste en levantar el brazo izquierdo, y usando tres dedos de la mano derecha, palpar el seno izquierdo en pequeños círculos alrededor del mismo. Se comienza en el borde externo para, gradualmente, ir hacia el pezón. Es importante presionar gentil pero firmemente el seno para buscar cualquier masa extraña bajo la piel.
4. Repetir el tercer paso en el seno derecho.
Es importante recordar que cada mujer es diferente y que algunos de los cambios que los pechos presentan pueden deberse a otros factores como: envejecimiento, el ciclo menstrual, el embarazo y la menopausia, entre otros.
Se considera que un tumor es pequeño cuando mide menos de 2 centímetros, generalmente son advertidos por la propia paciente.
Esta forma de tumor representa un 80% de los casos de cáncer de mama. En una segunda etapa los tumores llegan a medir entre 2 y 5 centímetros pero si llegan a etapas posteriores su tamaño puede ser superior a los 5 centímetros.
Según la Dra. Mirta Lanfranchi de Argentina “La importancia de efectuar el autoexamen mensualmente, por la propia mujer, radica en dos puntos principales: uno, porque de esa manera la mujer aprende a conocer sus mamas a través de la visualización y la palpación, y dos, porque una vez que la mujer, conoce cómo es su mama, va a estar capacitada para detectar cualquier cambio, aunque sea pequeño y poder, de esta manera, dirigirse a la consulta médica especializada en forma precoz”.
La autoexploración, es una herramienta básica de detección, que no debe sustituir los exámenes realizados por profesionales de la salud.
De ahí la importancia de realizar periódicamente una mamografía, el procedimiento más utilizado actualmente para la identificación de anormalidades en el pecho.
Una vez identificada una anormalidad, se debe realizar un examen mas profundo denominado Biopsia. La Biopsia es el único procedimiento que puede decir si la irregularidad encontrada es cancerígena.
En la actualidad, existe un método de biopsia mínimamente invasivo y nada doloroso, que se utiliza con anestesia local.
Mammotome, como se denomina esta nueva técnica, es una excelente alternativa, en lugar de la tradicional biopsia abierta que requiere de hospitalización, anestesia y suturas.
Mammotome tiene la capacidad de sustraer tejido del pecho, sin necesidad de remitir a la paciente a un hospital.
Este procedimiento toma menos de media hora y no deja cicatriz. La sonda de Mammotome tiene la capacidad de recoger varias muestras con una sola inserción.
Mammotome es distribuido por Women’s Health, una división de Johnson & Johnson.
Los doctores se han referido a este procedimiento como una innovación que permite
diagnosticar, de manera segura, cómoda y temprana la existencia del cáncer de seno en su etapa primaria, momento en que puede atacarse la enfermedad de manera radical.
A partir de la adolescencia, el mejor consejo que se le puede dar a toda mujer, según lo expresa la Dra. Lanfranchi – es:
“1) que practique el autoexamen mamario, y
2) si el médico le indica una mamografía, no tenga temor, ya que no es un método perjudicial para la salud, no es doloroso y es muy importante para detectar lesiones no palpables.”
“Un segundo método para detectar y diagnosticar lesiones – explica la profesional- es la ecografía mamaria, que tampoco duele y resulta útil sobretodo en mujeres jóvenes.
Junto con estos métodos de diagnóstico por imágenes, a veces el especialista necesita recurrir a algún estudio complementario para un diagnóstico más preciso y confiable.
Entre estos métodos se pueden mencionar la punción bajo el sistema Mammotome, que puede ser utilizado cuando la lesión aparece en la mamografía o en la ecografía – finaliza la Dra. Mirta Lanfranchi.
El cáncer de mama es uno de los cánceres con mayor incidencia en la población femenina. La manera más efectiva de combatirlo es a través de la detección temprana. Para que la lucha contra esta enfermedad sea más eficaz, es importante que la mujer tome conciencia de que es responsable de su salud y que en la medida que conozca mejor su cuerpo y que esté más informada de las nuevas técnicas a las que tiene acceso, mayor será la garantía de una vida mejor y más sana.
|

Detener a tiempo el cáncer de mama
Las mamografías anuales a mujeres de más de 40 años permiten detectar esta enfermedad en su fase inicial
//
Según los últimos estudios, el cáncer de mama afectará a un diez por ciento de mujeres a lo largo de su vida. Como medida de prevención los especialistas recomiendan a las mujeres de más de 40 años que realicen revisiones anuales mediante mamografías, ya que gracias al aumento de estos controles se ha conseguido que entre el 15-20 por ciento de los casos de cáncer se detecten en su fase inicial.
Hoy por hoy, la mamografía sigue siendo la única técnica mediante la que se pueden descubrir cánceres no avanzados y curables al cien por cien", explica el doctor Rafael Fábregas, jefe del Servicio de Ginecología General de USP Institut Universitari Dexeus.
Los programas de screening, que consisten en la realización de estudios poblacionales entre personas en principio sanas, pueden descubrir cánceres en su fase más inicial (carcinomas in situ) o, mejor aún, en la fase precancerosa.
La detección de lesiones precancerosas es más fácil en determinados órganos, como por ejemplo en el cuello del útero, pero "en la mama es difícil encontrar este tipo de lesiones, ya que el período de tiempo que transcurre entre la aparición de la lesión y su conversión en cáncer es muy breve", afirma el doctor Fábregas.
En el caso del cáncer de mama los programas de screening se basan en la realización de mamografías ya que es la mejor manera para detectarlo, sobre todo si se realizan de forma anual a las mujeres a partir de 40 años.
La mamografía permite detectar cánceres pequeños en su fase inicial, cuando todavía no han invadido el resto de la mama y cuyo tratamiento es muy específico. "Desde que se realizan estos reconocimientos, podemos diagnosticar el cáncer de mama en 15-20 por ciento en un estado tan inicial, que bastaría la cirugía para resolverlo", explica el doctor Máximo Izquierdo, ginecólogo de USP Institut Universitari Dexeus.
Uno de los principales problemas que existen para aplicar estos programas de screening es su alto coste económico, esto es lo que "hace que en algunas comunidades autónomas de nuestro país se lleven a cabo cada dos años, o bien a partir de los 50 años de edad", explica el doctor Fábregas.
El incremento de la incidencia del cáncer de mama en España en los últimos 5-10 años y la aparición de tumores a edades más tempranas hace que los especialistas se preocupen más por este diagnóstico precoz.
Futuros tratamientos
Actualmente el tratamiento más empleado para el cáncer de mama es la quimioterapia. La edad de la paciente, el tamaño del tumor y su extensión serán factores a tener en cuenta a la hora de determinar cuál será el tratamiento más adecuado. Lo que más preocupa de este tratamiento a los especialistas es la aparición de efectos secundarios ligados a los fármacos que se emplean en la quimioterapia.
"El control actual de la toxicidad de los tratamientos hace que los pacientes toleren mucho mejor la aplicación de los fármacos que hace diez años, aunque en algunos casos hay efectos inevitables, como la caída del cabello, hoy en día se controlan muy bien las náuseas y los vómitos, que hace unos años eran un problema gravísimo", aclara el doctor Javier Fabregat, oncólogo de USP Institut Universitari Dexeus.
La comunidad científica centra ahora sus investigaciones en el desarrollo de fármacos que actúen de forma específica contra las células malignas, a diferencia de lo que hace la quimioterapia, que actúa tanto sobre las células malignas como sobre las no malignas. De esta manera aumentaría la eficacia terapéutica sin añadir efectos secundarios, cosa que mejoraría la calidad de vida de las pacientes.
Mas material sobre cáncer
Cáncer Hepático Infantil
Este sumario sobre el tratamiento del cancer hepatico infantil es un compendio que abarca su pronostico, diagnostico, clasificacion y tratamiento.
El Instituto Nacional del Cancer (NCI por sus siglas en ingles) creo la base de datos PDQ para poner a su disposicion mas informacion sobre los nuevos tratamientos y su uso en los pacientes. La informacion y bibliografia de la literatura publicada mas recientemente sobre esta materia se incluye despues de ser revisadas por especialistas en oncologia pediatrica.
El cancer es poco comun en los ninos y adolescentes, y estos deben ser siempre referidos a centros medicos que cuenten con un personal medico multidisciplinario de especialistas en cancer con amplia experiencia en el tratamiento de los canceres que aparecen durante la ninez y la adolescencia.
Dicho personal debe contar con la pericia del medico de cabecera, subespecialistas en cirugia pediatrica, radioterapistas, oncologos y hematologos pediatras, especialistas en rehabilitacion, especialistas en enfermeria pediatrica, trabajadores sociales y otros, con el fin de asegurarse de que los pacientes reciban el tratamiento, apoyo terapeutico y rehabilitacion que determinen una calidad de vida y una supervivencia optima.
Las pautas para los centros de cancer pediatrico y su funcion en el tratamiento del paciente pediatrico con cancer han sido delineados por la Academia Americana de Pediatria.
En estos centros oncologicos pediatricos, se llevan a cabo ensayos clinicos para la mayoria de los canceres que se presentan en ninos y adolescentes, y a la mayoria de los pacientes/familiares se les ofrece la oportunidad de participar en estas prubas.
Estos ensayos clinicos para niños y adolescentes estan diseñados generalmente para comparar lo que se considera una terapia potencialmente mejor con la terapia que se considera estandard. la mayor parte del progreso alcanzado en la identificacion de terapias curativas para el cancer infantil, se ha logrado a traves de ensayos clinicos. Si necesita informacion sobre pruebas clinicas en curso del NCI, estas estan disponibles en (Http: //cancernet.nci.nih.gov/trialsrch.shtml).
El cancer hepatico, una neoplasia maligna poco comun en ninos y adolecentes, se divide en dos grandes subgrupos histologicos: hepatoblastoma y carcinoma hepatocelular.
La edad de inicio del cancer hepatico en ninos esta relacionada con la histologia del tumor.
El hepatoblastoma ocurre generalmente antes de los 3 anos de edad, mientras que la incidencia del carcinoma hepatocelular en los Estados Unidos varia poco con la edad entre 0 y 19 anos de edad.
La tasa de supervivencia general de los ninos con hepatoblastoma es 70% pero para los que tienen carcinoma hepatocelular es solamente 25%.
La mayoria de los pacientes sobrevive a la extraccion de un hepatblastoma que ha sido extraido por completo, pero solo una minoria de los pacientes tiene lesiones receptivas a una reseccion completa en el momento del diagnostico.
La imposibilidad de extraer completamente el tumor primario o la presencia de enfermedad metastatica se asocia con un resultado precario.
El hepatoblastoma suele ser unifocal, mientras que el carcinoma hepatocelular con frecuencia es ampliamente invasor o multicentrico. Por lo tanto, la reseccion es posible con mas frecuencia en el hepatoblastoma que en el carcinoma hepatocelular, en el cual menos del 30% es resecable.
La mayoria de los pacientes con hepatoblastoma o con carcinoma hepatocelular tiene un marcador tumoral serico, alfa-fetoproteina, que refleja en forma paralela la actividad de la enfermedad. La falta de disminucion significativa en los niveles de alfa-fetoproteina con el tratamiento puede predecir una mala respuesta a la terapia.
La ausencia de alfa-fetoproteina elevada puede ser un signo pronostico precario en el hepatoblastoma, ya que esta asociada con la variante histologica de celula pequena (anaplastica) que responde de forma muy precaria a la terapia.
Ocasionalmente los hepatoblastomas producen gonadotropina corionica beta-humana que produce como resultado la precocidad isosexual. La osteopenia severa es comun.
El hepatoblastoma es parte de la constelacion de hallazgos asociados con el sindrome de Beckwith-Wiedemann.
En muchos hepatoblastomas ocurre una perdida del alelo maternal en el 11p15.5 familiar del locus del sindrome de Beckwith- Wiedemann.
Asi que la anormalidad genetica que da como resultado el sindrome de Beckwith Wiedemann podria estar directamente involucrada en algunos casos en la patogenesis del hepatoblastoma y la impresion podria desempenar un papel.
Alrededor de 2% de los ninos que padecen de hepatoblastoma tienen hemihipertrofia.
Existe ademas una asociacion clara entre el hepatoblastoma y la poliposis adenomatosa familiar (FA, siglas en ingles), por lo que los ninos de familias portadoras del gen FA corren un riesgo mayor de padecer un hepatoblastoma, aunque este ocurre en menos del 1% de los miembros de la familia que tiene FA. Tambien se ha informado de la existencia de una relacion entre los ninos de peso bajo al nacer y los hepatoblastomas.
El carcinoma hepatocelular esta asociado con la infeccion de la hepatitis B y C, especialmente en ninos que adquirieron el virus en el periodo perinatal. Por eso la inmunizacion general contra la hepatitis B podria disminuir la incidencia del carcinoma hepatocelular.
El periodo de incubacion entre la infeccion del virus de la hepatitis y la genesis del carcinoma hepatocelular, es extremadamente corto en algunos ninos que han adquirido el virus en el periodo perinatal, en comparacion con el de los adultos.
En el carcinoma hepatocelular infantil ocurren mutaciones en el gen del factor de crecimiento Met/hepatocito y estas podrian ser el mecanismo que da como resultado el periodo mas corto de incubacion.
En los ninos se asocian varios tipos especificos de cirrosis y lesiones no virales del higado con el carcinoma hepatocelular: tirosinemia, cirrosis biliar y deficiencia de alfa-1-antitripsina.
Bibliografia:
Sanders J, Glader B, Cairo M, et al.: Guidelines for the pediatric cancer center and role of such centers in diagnosis and treatment. American Academy of Pediatrics Section Statement Section on Hematology/Oncology. Pediatrics 99(1): 139-141, 1997.
Cancer incidence and survival among children and adolescents: United States SEER Program 1975-1995. In: SEER Pediatric Monograph Web Site. , Available at: Http: //www-seer.ims.nci.nih.gov/Publications/PedMono. Accessed 8/31/99.
Ortega JA, Krailo MD, Haas JE, et al.: Effective treatment of unresectable or metastatic hepatoblastoma with cisplatin and continuous infusion doxorubicin chemotherapy: a report from the Childrens Cancer Study Group. Journal of Clinical Oncology 9(12): 2167-2176, 1991.
Douglass EC, Reynolds M, Finegold M, et al.: Cisplatin, vincristine, and fluorouracil therapy for hepatoblastoma: a Pediatric Oncology Group study. Journal of Clinical Oncology 11(1): 96-99, 1993.
Ortega JA, Douglass E, Feusner J, et al.: A randomized trial of cisplatin (DDP)/vincristine (VCR)/ 5-fluorouracil (5FU) vs. DDP/doxorubicin (DOX) i.v. continuous infusion (CI) for the treatment of hepatoblastoma (HB): results from the Pediatric Intergroup Hepatoma Study (CCG-8881/POG-8945). Proceedings of the American Society of Clinical Oncology 13: A-1421, 416, 1994.
Douglass E, Ortega J, Feusner J, et al.: Hepatocellular carcinoma (HCA) in children and adolescents: results from the Pediatric Intergroup Hepatoma Study (CCG 8881/POG 8945). Proceedings of the American Society of Clinical Oncology 13: A-1439, 420, 1994.
Exelby PR, Filler RM, Grosfeld JL: Liver tumors in children in the particular reference to hepatoblastoma and hepatocellular carcinoma: American Academy of Pediatrics surgical section survey - 1974. Journal of Pediatric Surgery 10(3): 329-337, 1975.
Van Tornout JM, Buckley JD, Quinn JJ, et al.: Timing and magnitude of decline in alpha-fetoprotein levels in treated children with unresectable or metastatic hepatoblastoma are predictors of outcome: a report from the Children's Cancer Group. Journal of Clinical Oncology 15(3): 1190-1197, 1997.
Sotelo-Avila C, Gonzalez-Crussi F, Fowler JW: Complete and incomplete forms of Beckwith-Wiedemann syndrome: their oncogenic potential. Journal of Pediatrics 96(1): 47-50, 1980.
Albrecht S, von Schweinitz D, Waha A, et al.: Loss of maternal alleles on chromosome 11p in hepatoblastoma. Cancer Research 54(19): 5041-5044, 1994.
Mannens M, Hoovers JM, Redeker E, et al.: Parental imprinting of human chromosome region 11p15.3-pter involved in the Beckwith-Wiedemann syndrome and various human neoplasia. European Journal of Human Genetics 2(1): 3-23, 1994.
Fraumeni JF, Miller RW, Hill JA: Primary carcinoma of the liver in childhood: an epidemiologic study. Journal of the National Cancer Institute 40(5): 1087-1099, 1968.
Iwama T, Mishima Y: Mortality in young first-degree relatives of patients with familial adenomatous polyposis. Cancer 73(8): 2065-2068, 1994.
Li FP, Thurber WA, Seddon J, et al.: Hepatoblastoma in families with polyposis coli. Journal of the American Medical Association 257(18): 2475-2477, 1987.
Garber JE, Li FP, Kingston JE, et al.: Hepatoblastoma and familial adenomatous polyposis. Journal of the National Cancer Institute 80(20): 1626-1628, 1988.
Koch A, Denkhaus D, Albrecht S, et al.: Childhood hepatoblastomas frequently carry a mutated degradation targeting box of the beta-catenin gene. Cancer Research 59(2): 269-273, 1999.
Ikeda H, Hachitanda Y, Tanimura M, et al.: Development of unfavorable hepatoblastoma in children of very low birth weight: results of a surgical and pathologic review. Cancer 82(9): 1789-1796, 1998.
Maruyama K, Ikeda H, Koizumi T, et al.: Prenatal and postnatal histories of very low birthweight infants who developed hepatoblastoma. Pediatrics International 41(1): 82-89, 1999.
Ni YH, Chang MH, Hsu HY, et al.: Hepatocellular carcinoma in childhood: clinical manifestations and prognosis. Cancer 68(8): 1737-1741, 1991.
Tsukuma H, Hiyama T, Tanaka S, et al.: Risk factors for hepatocellular carcinoma among patients with chronic liver disease. New England Journal of Medicine 328(25): 1797-1801, 1993.
Chang MH, Chen CJ, et al, for the Taiwan Childhood Hepatoma Study Group: Universal hepatitis B vaccination in Taiwan and the incidence of hepatocellular carcinoma in children. New England Journal of Medicine 336(26): 1855-1859, 1997.
Park WS, Dong SM, Kim SY, et al.: Somatic mutations in the kinase domain of the Met/hepatocyte growth factor receptor gene in childhood hepatocellular carcinomas. Cancer Research 59(2): 307-310, 1999.
CLASIFICACION CELULAR
Las celulas del carcinoma hepatocelular de tipo "adulto" son epiteliales comparadas con una apariencia embrionaria menos diferenciada del hepatoblastoma.
El carcinoma hepatocelular tambien difiere del hepatoblastoma en que a menudo surge en un higado cirrotico previamente anormal.
Sin embargo, el carcinoma hepatocelular en los ninos, a diferencia de los adultos, no surge de higados cirroticos. Ambos tipos histologicos surgen mas comunmente en el lobulo derecho del higado. La naturaleza hepatocelular de las celulas tumorales puede demostrarse al encontrar AFP o alfa-1-antitripsina.
Un analisis de pacientes con hepatoblastoma resecable ha sugerido que los tumores que se caracterizan por tener una histologia puramente "fetal" tienen un pronostico mejor que aquellos que tienen un agregado de componentes embrionarios mas primitivos y de division rapida u otros tejidos no diferenciados.
Ademas, se ha descrito la existencia de una variante histologica distintiva de carcinoma hepatocelular en los higados no cirroticos de ninos mayores y adultos jovenes. Esta variante, llamada carcinoma fibrolamelar, se ha asociado con un pronostico mejor.
Bibliografia:
Ishak KG, Glunz PR: Hepatoblastoma and hepatocarcinoma in infancy and childhood: report of 47 cases. Cancer 20(3): 396-422, 1967.
Weinberg AG, Finegold MJ: Primary hepatic tumors of childhood. Human Pathology 14(6): 512-537, 1983.
Haas JE, Muczynski KA, Krailo M, et al.: Histopathology and prognosis in childhood hepatoblastoma and hepatocarcinoma. Cancer 64(5): 1082-1095, 1989.
Lack EE, Neave C, Vawter GF: Hepatocellular carcinoma: review of 32 cases in childhood and adolescence. Cancer 52(8): 1510-1515, 1983.
Craig JR, Peters RL, Edmondson HA, et al.: Fibrolamellar carcinoma of the liver: a tumor of adolescents and young adults with distinctive clinico-pathologic features. Cancer 46(2): 372-379, 1980.
Farhi DC, Shikes RH, Murari PJ, et al.: Hepatocellular carcinoma in young people. Cancer 52(8): 1516-1525, 1983.
INFORMACION DE LAS ETAPAS
Para agrupar a los ninos con cancer hepatico se ha empleado un sistema de clasificacion basado en la extension postquirurgica del tumor y en la posibilidad de reseccion quirurgica. Este sistema de clasificacion se emplea para determinar el tratamiento.
Los ninos diagnosticados con hepatoblastomas en etapa I y II tienen una tasa de curacion mayor del 90% en comparacion con el 60% que representa la etapa III y el 20% que representa la etapa IV. Los ninos diagnosticados con carcinoma hepatocelular en etapa I obtienen buenos resultados.
La etapa II constituye un caso raro pocas veces visto por lo que no se puede predecir los resultados, y las etapas III y IV son generalmente mortales. La variante fibrolamelar del carcinoma hepatocelular podria tener un mejor resultado.
Etapa I
No hay metastasis, tumor completamente resecado.
Etapa II
No hay metastasis, tumor resecado de forma macroscopica con enfermedad residual microscopica (es decir, margenes positivos); ruptura del tumor o tumor esparcido durante la cirugia.
Etapa III
No hay metastasis distantes, tumor irresecable o resecable con tumor residual macroscopico o ganglios linfaticos positivos.
Etapa IV
hay metastasis distantes sin importar el grado de complicacion hepatica.
Bibliografia:
Ortega JA, Krailo MD, Haas JE, et al.: Effective treatment of unresectable or metastatic hepatoblastoma with cisplatin and continuous infusion doxorubicin chemotherapy: a report from the Childrens Cancer Study Group. Journal of Clinical Oncology 9(12): 2167-2176, 1991.
Douglass EC, Reynolds M, Finegold M, et al.: Cisplatin, vincristine, and fluorouracil therapy for hepatoblastoma: a Pediatric Oncology Group study. Journal of Clinical Oncology 11(1): 96-99, 1993.
Ortega JA, Douglass E, Feusner J, et al.: A randomized trial of cisplatin (DDP)/vincristine (VCR)/ 5-fluorouracil (5FU) vs. DDP/doxorubicin (DOX) i.v. continuous infusion (CI) for the treatment of hepatoblastoma (HB): results from the Pediatric Intergroup Hepatoma Study (CCG-8881/POG-8945). Proceedings of the American Society of Clinical Oncology 13: A-1421, 416, 1994.
Douglass E, Ortega J, Feusner J, et al.: Hepatocellular carcinoma (HCA) in children and adolescents: results from the Pediatric Intergroup Hepatoma Study (CCG 8881/POG 8945). Proceedings of the American Society of Clinical Oncology 13: A-1439, 420, 1994.
Giacomantonio M, Ein SH, Mancer K, et al.: Thirty years of experience with pediatric primary malignant liver tumors. Journal of Pediatric Surgery 19(5): 523-526, 1984.
ASPECTOS GENERALES DE LAS OPCIONES DE TRATAMIENTO
Muchas de las mejoras en la supervivencia del cancer infantil se han logrado gracias al uso de nuevas terapias que han intentado superar los mejores tratamientos aceptados disponibles.
Las pruebas clinicas en pediatria estan disenadas para comparar terapias potencialmente mejores con aquellas que actualmente se aceptan como estandar.
Esta comparacion puede hacerse en un estudio aleatorio de dos brazos de tratamiento o mediante la evaluacion de un solo tratamiento nuevo, comparando sus resultados con aquellos anteriormente obtenidos con terapia estandar.
Debido a que el cancer infantil es relativamente poco comun, todos los ninos con cancer hepatico deben ser considerados para la inclusion en pruebas clinicas.
Para poder determinar el tratamiento optimo y ejecutarlo es necesaria la planificacion del tratamiento por parte de un grupo multidisciplinario de especialistas en cancer con experiencia en el tratamiento de tumores infantiles. Resulta critica la intervencion de cirujanos con experiencia en la reseccion pediatrica del higado.
Historicamente se ha necesitado la reseccion del tumor primario para curar los tumores hepaticos malignos en los ninos. La quimioterapia preoperatoria puede convertir un tumor irresecable en uno resecable.
A veces la quimioterapia es capaz de erradicar completamente las metastasis pulmonares y eliminar los focos de tumores multinodulares en el higado. La quimioterapia ha tenido mucho mas exito en el tratamiento del hepatoblastoma que en el del carcinoma hepatocelular
En los ultimos anos, practicamente todos los ninos con hepatoblastoma han sido tratados con quimioterapia y, en algunos centros, hasta los ninos con hepatoblastoma resecable son tratados con quimioterapia preoperatoria, que puede reducir la incidencia de complicaciones quirurgicas en el momento de la reseccion.
En contraste, el protocolo actual del Intergroup para el tratamiento de ninos con hepatoblastoma no trata los tumores de histologia puramente fetal en etapa I con quimioterapia a no ser que desarrollen enfermedad progresiva; y alienta la reseccion al momento del diagnostico en el caso de cualquier tumor tratable con reseccion sin riesgos excesivos.
La reseccion quirurgica de enfermedad distante tambien ha contribuido a la cura de ninos con hepatoblastoma.
La reseccion de metastasis pulmonares se recomienda cuando el numero de metastasis es limitado y suele hacerse al mismo tiempo que la reseccion del tumor primario. Cuando es posible, la reseccion de areas de enfermedad invasora local, como en el diafragma, y de metastasis aisladas del cerebro tambien se recomiendan
La radioterapia, aun en combinacion con la quimioterapia, no ha curado los tumores pediatricos irresecables. Sin embargo, puede que haya una funcion para la radioterapia en el manejo de los hepatoblastomas que no se han resecado completamente.
La dosis de radiacion que puede darse con seguridad inmediatamente despues de la reseccion esta limitada por su menoscabo de la regeneracion del higado.
El transplante del higado se ha utilizado con algun exito para tratar tumores hepaticos irresecables en los ninos. Algunos ninos con pronostico adverso debido a metastasis pulmonares o de los ganglios linfaticos se han curado con un transplante despues que la quimioterapia tuvo exito en controlar las metastasis.
Debido a que las metastasis tardias suelen ocurrir con mas frecuencia en el carcinoma hepatocelular que en el hepatoblastoma, la supervivencia despues del transplante del higado en estos pacientes es menor. La variante fibrolamelar del carcinoma hepatocelular podria obtener mejores resultados con el transplante del higado que otros carcinomas hepatocelulares.
Las designaciones en PDQ que indican que un tratamiento es "estandar" o que esta "bajo evaluacion clinica" no deben emplearse como base para determinar reembolsos.
Bibliografia:
Ortega JA, Krailo MD, Haas JE, et al.: Effective treatment of unresectable or metastatic hepatoblastoma with cisplatin and continuous infusion doxorubicin chemotherapy: a report from the Childrens Cancer Study Group. Journal of Clinical Oncology 9(12): 2167-2176, 1991.
Douglass EC, Reynolds M, Finegold M, et al.: Cisplatin, vincristine, and fluorouracil therapy for hepatoblastoma: a Pediatric Oncology Group study. Journal of Clinical Oncology 11(1): 96-99, 1993.
Ortega JA, Douglass E, Feusner J, et al.: A randomized trial of cisplatin (DDP)/vincristine (VCR)/ 5-fluorouracil (5FU) vs. DDP/doxorubicin (DOX) i.v. continuous infusion (CI) for the treatment of hepatoblastoma (HB): results from the Pediatric Intergroup Hepatoma Study (CCG-8881/POG-8945). Proceedings of the American Society of Clinical Oncology 13: A-1421, 416, 1994.
Douglass E, Ortega J, Feusner J, et al.: Hepatocellular carcinoma (HCA) in children and adolescents: results from the Pediatric Intergroup Hepatoma Study (CCG 8881/POG 8945). Proceedings of the American Society of Clinical Oncology 13: A-1439, 420, 1994.
Bowman LC, Pediatric Oncology Group: Phase III Randomized Study of Postoperative Cisplatin, Vincristine, and Fluorouracil With or Without Amifostine Versus Carboplatin and Cisplatin With or Without Amifostine in Children With Hepatoblastoma (Summary Last Modified 03/2000), POG-9645, clinical trial, active, 03/15/1999.
Feusner JH, Krailo MD, Haas JE, et al.: Treatment of pulmonary metastases of initial stage I hepatoblastoma in childhood: report from the Childrens Cancer Group. Cancer 71(3): 859-864, 1993.
Robertson PL, Muraszko KM, Axtell RA: Hepatoblastoma metastatic to brain: prolonged survival after multiple surgical resections of a solitary brain lesion. Journal of Pediatric Hematology/Oncology 19(2): 168-171, 1997.
Habrand JL, Nehme D, Kalifa C, et al.: Is there a place for radiation therapy in the management of hepatoblastomas and hepatocellular carcinomas in children? International Journal of Radiation Oncology, Biology, Physics 23(3): 525-531, 1992.
Koneru B, Flye MW, Busuttil RW, et al.: Liver transplantation for hepatoblastoma: the American experience. Annals of Surgery 213(2): 118-121, 1991.
Bilik R, Superina R: Transplantation for unresectable liver tumors in children. Transplant Proceedings 29(7): 2834-2835, 1997.
Venook AP: Treatment of hepatocellular carcinoma: too many options? Journal of Clinical Oncology 12(6): 1323-1334, 1994.
CANCER HEPATICO INFANTIL - ETAPA I y II
Hepatoblastoma, etapa I y II
Se ha demostrado que la quimioterapia de combinacion ofrece beneficios significativos en ninos con hepatoblastoma. La quimioterapia a base de cisplatino ha resultado en un beneficio en la supervivencia de mas del 90% para ninos con enfermedad en etapas I y II.
En comparacion, una encuesta de ninos con tumores del higado tratados antes del uso consistente de quimioterapia de combinacion encontro que de 78 pacientes con hepatoblastoma que se sometieron a una escision del tumor sobrevivieron 45.
Una prueba clinica aleatoria ha demostrado eficacia comparable entre el tratamiento de hepatoblastomas con cisplatino/vincristina/fluorouracilo y el tratamiento con cisplatino/doxorrubicina, aunque la combinacion de cisplatino/vincristina/fluorouracilo produjo un nivel considerablemente menor de toxicidad.
Opciones de tratamiento:
Escision quirurgica completa seguida por cuatro cursos de quimioterapia de combinacion con cisplatino, vincristina y fluorouracilo o una combinacion comparable de quimioterapia. El tumor con escision completa de histologia puramente fetal puede ser tratado con doxorrubicina sola o seguido cuidadosamente sin terapia adicional
Carcinoma hepatocelular, etapa I y II
En una prueba aleatoria, de siete pacientes con carcinoma hepatocelular en etapa I sobrevivieron todos, libres de enfermedad, despues de recibir quimioterapia adyuvante a base de cisplatino.[
En una encuesta de tumores del higado de la infancia tratados antes del uso sistematico de quimioterapia, solo sobrevivieron 12 de 33 pacientes con carcinoma hepatocelular que se sometieron a una excision completa del tumor.
Es probable que la quimioterapia adyuvante si beneficie a los ninos con carcinoma hepatocelular completamente resecado. El tratamiento con cisplatino y doxorrubicina puede ser recomendado como terapia adyuvante, ya que estos son agentes activos en el tratamiento del carcinoma hepatocelular. (Para mayor informacion, ver el sumario del PDQ sobre el tratamiento del primario del higado en adultos.)
Bibliografia:
Ortega JA, Krailo MD, Haas JE, et al.: Effective treatment of unresectable or metastatic hepatoblastoma with cisplatin and continuous infusion doxorubicin chemotherapy: a report from the Childrens Cancer Study Group. Journal of Clinical Oncology 9(12): 2167-2176, 1991.
Douglass EC, Reynolds M, Finegold M, et al.: Cisplatin, vincristine, and fluorouracil therapy for hepatoblastoma: a Pediatric Oncology Group study. Journal of Clinical Oncology 11(1): 96-99, 1993.
Exelby PR, Filler RM, Grosfeld JL: Liver tumors in children in the particular reference to hepatoblastoma and hepatocellular carcinoma: American Academy of Pediatrics surgical section survey - 1974. Journal of Pediatric Surgery 10(3): 329-337, 1975.
Ortega JA, Douglass E, Feusner J, et al.: A randomized trial of cisplatin (DDP)/vincristine (VCR)/ 5-fluorouracil (5FU) vs. DDP/doxorubicin (DOX) i.v. continuous infusion (CI) for the treatment of hepatoblastoma (HB): results from the Pediatric Intergroup Hepatoma Study (CCG-8881/POG-8945). Proceedings of the American Society of Clinical Oncology 13: A-1421, 416, 1994.
Douglass E, Ortega J, Feusner J, et al.: Hepatocellular carcinoma (HCA) in children and adolescents: results from the Pediatric Intergroup Hepatoma Study (CCG 8881/POG 8945). Proceedings of the American Society of Clinical Oncology 13: A-1439, 420, 1994.
CANCER HEPATICO INFANTIL - ETAPA III
Hepatoblastoma, etapa III
En aproximadamente el 75% de los ninos y adolescentes con hepatoblastoma inicialmente no resecable, los tumores pueden volverse resecables con quimioterapia preoperatoria a base de cisplatino, y entre 60% y 65% sobreviven libres de enfermedad. Una prueba clinica aleatoria ha demostrado la misma eficacia entre el tratamiento de hepatoblastoma con cisplatino/vincristina/fluorouracilo y el tratamiento con cisplatino/doxorrubicina, aunque la combinacion de cisplatino/vincristina/fluorouracilo produjo un nivel considerablemente menor de toxicidad.
La combinacion de ifosfamida, cisplatino y doxorrubicina tambien ha sido usada con exito en el tratamiento de la enfermedad en etapa avanzada.
Los pacientes cuyos tumores permanecen irresecables deben ser considerados para quimioterapia alternativa, tal como dosis elevadas de cisplatino con etoposido,radioterapia, infusion hepatica directa de agentes quimioterapeuticos,o trasplante ortotopico del higado.
En investigacion: quimioterapia de combinacion con cisplatino y carboplatino.
Carcinoma hepatocelular, etapa III
En una prueba aleatoria, la quimioterapia con cisplatino/vincristina/fluorouracilo con o sin doxorrubicina administrada por infusion continua fue ineficaz como tratamiento del carcinoma hepatocelular no
resecable. La terapia fallo en 23 de 26 pacientes con enfermedad en etapa III.
Ningun tratamiento en particular para el carcinoma hepatocelular no resecable ha probado ser especialmente eficaz en el grupo de edad pediatrica.
Ciertos pacientes pueden beneficiarse del tratamiento con terapia de cisplatino/doxorrubicina, especialmente si el tumor hepatico localizado se reduce adecuadamente para permitir la reseccion de la enfermedad. Varias opciones terapeuticas han producido resultados exitosos en algunos adultos con carcinoma hepatocelular: criocirugia, inyeccion intratumoral de alcohol, metodos radioterapeuticos y transplante del higado. (Para mayor informacion, ver elsumario del PDQ sobre el tratamiento del primario del higado en adultos.)
Bibliografia:
Ortega JA, Douglass E, Feusner J, et al.: A randomized trial of cisplatin (DDP)/vincristine (VCR)/ 5-fluorouracil (5FU) vs. DDP/doxorubicin (DOX) i.v. continuous infusion (CI) for the treatment of hepatoblastoma (HB): results from the Pediatric Intergroup Hepatoma Study (CCG-8881/POG-8945). Proceedings of the American Society of Clinical Oncology 13: A-1421, 416, 1994.
von Schweinitz D, Hecker H, Harms D, et al.: Complete resection before development of drug resistance is essential for survival from advanced hepatoblastoma - a report from the German Cooperative Pediatric Liver Tumor study HB-89. Journal of Pediatric Surgery 30(6): 845-852, 1995.
Douglass EC, Pediatric Oncology Group: Phase II Study of CBDCA and CBDCA/5-FU/VCR in Pediatric Patients with Unresectable or Metastatic (Stage III/IV) Hepatoblastoma, with CDDP/VP-16 for Those Who Remain Unresectable Following Initial Chemotherapy (Summary Last Modified 09/93), POG-9345, clinical trial, closed, 02/15/1995.
Douglass EC, Reynolds M, Finegold M, et al.: Cisplatin, vincristine, and fluorouracil therapy for hepatoblastoma: a Pediatric Oncology Group study. Journal of Clinical Oncology 11(1): 96-99, 1993.
Habrand JL, Nehme D, Kalifa C, et al.: Is there a place for radiation therapy in the management of hepatoblastomas and hepatocellular carcinomas in children? International Journal of Radiation Oncology, Biology, Physics 23(3): 525-531, 1992.
Sue K, Ikeda K, Nakagawara A, et al.: Intrahepatic arterial injections of cisplatin-phosphatidylcholine-lipiodol suspension in two unresectable hepatoblastoma cases. Medical and Pediatric Oncology 17(6): 496-500, 1989.
Koneru B, Flye MW, Busuttil RW, et al.: Liver transplantation for hepatoblastoma: the American experience. Annals of Surgery 213(2): 118-121, 1991.
Bilik R, Superina R: Transplantation for unresectable liver tumors in children. Transplant Proceedings 29(7): 2834-2835, 1997.
Laine J, Jalanko H, Saarinen-Pihkala UM, et al.: Successful liver transplantation after induction chemotherapy in children with inoperable, multifocal primary hepatic malignancy. Transplantation 67(10): 1369-1372, 1999.
Bowman LC, Pediatric Oncology Group: Phase III Randomized Study of Postoperative Cisplatin, Vincristine, and Fluorouracil With or Without Amifostine Versus Carboplatin and Cisplatin With or Without Amifostine in Children With Hepatoblastoma (Summary Last Modified 03/2000), POG-9645, clinical trial, active, 03/15/1999.
Douglass E, Ortega J, Feusner J, et al.: Hepatocellular carcinoma (HCA) in children and adolescents: results from the Pediatric Intergroup Hepatoma Study (CCG 8881/POG 8945). Proceedings of the American Society of Clinical Oncology 13: A-1439, 420, 1994.
CANCER HEPATICO INFANTIL - ETAPA IV
Hepatoblastoma, etapa IV
El resultado para el hepatoblastoma que es metastatico en el momento del diagnostico no es bueno, pero la curacion es posible entre el 25% y el 30% de los pacientes.
Si es posible, los pacientes en etapa IV con tumor primario resecado deben hacer que se les extraiga quirurgicamente cualquier residuo de metastasis pulmonar. Una prueba clinica aleatoria ha demostrado la misma eficacia en el tratamiento de hepatoblastoma con cisplatino/vincristina/fluorouracilo que con cisplatino/doxorrubicina, aunque el combinacion de cisplatino/vincristina/fluorouracilo produjo un nivel considerablemente menor de toxicidad.
La combinacion de ifosfamida, cisplatino y doxorrubicina tambien ha sido usada con exito en el tratamiento de la enfermedad en etapa avanzada
Los pacientes cuyos tumores permanecen irresecables deben ser considerados para quimioterapia alternativa, tal como dosis elevadas de cisplatino con etoposido, radioterapia,] infusion hepatica directa de agentes quimioterapeuticos o, si se controla la enfermedad metastatica, trasplante ortotopico del higado.
Opciones de tratamiento:
Cuatro cursos de cisplatino/vincristina/fluorouracilo seguido de un intento de reseccion completa del tumor. Si el tumor es extraido completamente, deben administrarse dos cursos postoperatorios de la misma quimioterapia.
Si el tumor no es resecable despues de cuatro cursos de quimioterapia, deben considerarse terapias alternativas.
En evaluacion: quimioterapia de combinacion con cisplatino y carboplatino
Terapias alternativas:
1. Quimioterapia con dosis elevadas de cisplatino/etoposido o infusion continua de doxorrubicina.
2. Radioterapia seguida de reexploracion si esta controlada la enfermedad metastatica.
3. Quimioembolizacion por infusion arterial hepatica.
4. Trasplante ortotopico del higado si la enfermedad metastatica esta controlada.
5. Pruebas clinicas de quimioterapia de fase I o II.
Carcinoma hepatocelular, etapa IV
En una prueba aleatoria, la quimioterapia con cisplatino/vincristina/fluorouracilo con o sin doxorrubicina administrada por infusion continua fue ineficaz como tratamiento del carcinoma hepatocelular no resecable.
La terapia fallo en 12 de 13 pacientes con enfermedad en etapa IV.
Ningun tratamiento en particular para el carcinoma hepatocelular no resecable ha probado ser especialmente eficaz en el grupo de edad pediatrica.
Ciertos pacientes pueden beneficiarse del tratamiento con terapia de cisplatino/doxorrubicina, especialmente si el tumor hepatico localizado se reduce adecuadamente para permitir la reseccion de la enfermedad. (Para mayor informacion, ver el sumario del PDQ sobre el tratamiento del primario del higado en adultos.)
Bibliografia:
Ortega JA, Krailo MD, Haas JE, et al.: Effective treatment of unresectable or metastatic hepatoblastoma with cisplatin and continuous infusion doxorubicin chemotherapy: a report from the Childrens Cancer Study Group. Journal of Clinical Oncology 9(12): 2167-2176, 1991.
Douglass EC, Reynolds M, Finegold M, et al.: Cisplatin, vincristine, and fluorouracil therapy for hepatoblastoma: a Pediatric Oncology Group study. Journal of Clinical Oncology 11(1): 96-99, 1993.
Ortega JA, Douglass E, Feusner J, et al.: A randomized trial of cisplatin (DDP)/vincristine (VCR)/ 5-fluorouracil (5FU) vs. DDP/doxorubicin (DOX) i.v. continuous infusion (CI) for the treatment of hepatoblastoma (HB): results from the Pediatric Intergroup Hepatoma Study (CCG-8881/POG-8945). Proceedings of the American Society of Clinical Oncology 13: A-1421, 416, 1994.
von Schweinitz D, Hecker H, Harms D, et al.: Complete resection before development of drug resistance is essential for survival from advanced hepatoblastoma - a report from the German Cooperative Pediatric Liver Tumor study HB-89. Journal of Pediatric Surgery 30(6): 845-852, 1995.
Douglass EC, Pediatric Oncology Group: Phase II Study of CBDCA and CBDCA/5-FU/VCR in Pediatric Patients with Unresectable or Metastatic (Stage III/IV) Hepatoblastoma, with CDDP/VP-16 for Those Who Remain Unresectable Following Initial Chemotherapy (Summary Last Modified 09/93), POG-9345, clinical trial, closed, 02/15/1995.
Habrand JL, Nehme D, Kalifa C, et al.: Is there a place for radiation therapy in the management of hepatoblastomas and hepatocellular carcinomas in children? International Journal of Radiation Oncology, Biology, Physics 23(3): 525-531, 1992.
Sue K, Ikeda K, Nakagawara A, et al.: Intrahepatic arterial injections of cisplatin-phosphatidylcholine-lipiodol suspension in two unresectable hepatoblastoma cases. Medical and Pediatric Oncology 17(6): 496-500, 1989.
Koneru B, Flye MW, Busuttil RW, et al.: Liver transplantation for hepatoblastoma: the American experience. Annals of Surgery 213(2): 118-121, 1991.
Bilik R, Superina R: Transplantation for unresectable liver tumors in children. Transplant Proceedings 29(7): 2834-2835, 1997.
Laine J, Jalanko H, Saarinen-Pihkala UM, et al.: Successful liver transplantation after induction chemotherapy in children with inoperable, multifocal primary hepatic malignancy. Transplantation 67(10): 1369-1372, 1999.
Bowman LC, Pediatric Oncology Group: Phase III Randomized Study of Postoperative Cisplatin, Vincristine, and Fluorouracil With or Without Amifostine Versus Carboplatin and Cisplatin With or Without Amifostine in Children With Hepatoblastoma (Summary Last Modified 03/2000), POG-9645, clinical trial, active, 03/15/1999.
Douglass E, Ortega J, Feusner J, et al.: Hepatocellular carcinoma (HCA) in children and adolescents: results from the Pediatric Intergroup Hepatoma Study (CCG 8881/POG 8945). Proceedings of the American Society of Clinical Oncology 13: A-1439, 420, 1994.
CANCER HEPATICO INFANTIL RECURRENTE
Hepatoblastoma recurrente
El pronostico para un paciente con hepatoblastoma recurrente o progresivo depende de muchos factores, incluyendo el sitio de recurrencia, el tratamiento previo y las consideraciones individuales de cada paciente.
Por ejemplo, en pacientes con hepatoblastoma en etapa I en el diagnostico inicial, el tratamiento quirurgico agresivo de metastasis pulmonares aisladas que se desarrollan en el curso de la enfermedad puede hacer que la extension de la supervivencia libre de enfermedad sea posible.
Si es posible, las metastasis aisladas deberian ser resecadas completamente en pacientes en los cuales el tumor primario es controlado.
La pruebas clinicas en fase I y II pueden ser apropiadas y deben considerarse.
Carcinoma hepatocelular recurrente
El pronostico para un paciente con carcinoma hepatocelular recurrente o progresivo es precario. Las pruebas clinicas en fase I y II pueden ser apropiadas y deben considerarse. (Para mayor informacion, ver el sumario del PDQ sobre el tratamiento del cancer primario del higado en adultos.)
Bibliografia:
Feusner JH, Krailo MD, Haas JE, et al.: Treatment of pulmonary metastases of initial stage I hepatoblastoma in childhood: report from the Childrens Cancer Group. Cancer 71(3): 859-864, 1993.
Robertson PL, Muraszko KM, Axtell RA: Hepatoblastoma metastatic to brain: prolonged survival after multiple surgical resections of a solitary brain lesion. Journal of Pediatric Hematology/Oncology 19(2): 168-171, 1997.
CANCER DE INTESTINO DELGADO.-
NFORMACION GENERAL
Dependiendo de la histología, el cáncer del intestino delgado es tratable y a veces curable. Los adenocarcinomas, linfomas, sarcomas y tumores carcinoides representan la mayoría de las neoplasias malignas del intestino delgado que, en su totalidad, representan sólo del 1% a 2% de todas las neoplasias malignas gastrointestinales.
Como en otras neoplasias malignas gastrointestinales, la modalidad predominante de tratamiento es cirugía, cuando la resección es posible, y la curación se relaciona con la capacidad de resecar completamente el cáncer.
La supervivencia general a 5 años para adenocarcinoma resecable es de sólo 20%. La supervivencia a 5 años para leiomiosarcoma resecable, el sarcoma primario más común del intestino delgado, es de aproximadamente 50%. Los tumores carcinoides del intestino delgado se discuten en otro documento como un cáncer distinto; (Para mayor información, ver el sumario del PDQ sobre el tratamiento del tumor carcinoide gastrointestinal.) El linfoma del intestino delgado se trata brevemente aquí; (Para mayor información, ver el sumario del PDQ sobre el tratamiento del linfoma no Hodgkin.)
Bibliografía:
 Coit DG: Cancer of the small intestine. In: DeVita VT Jr, Hellman S, Rosenberg SA, eds.: Cancer: Principles and Practice of Oncology. Philadelphia, Pa: Lippincott-Raven Publishers, 5th ed., 1997, pp 1128-1143.
Coit DG: Cancer of the small intestine. In: DeVita VT Jr, Hellman S, Rosenberg SA, eds.: Cancer: Principles and Practice of Oncology. Philadelphia, Pa: Lippincott-Raven Publishers, 5th ed., 1997, pp 1128-1143.
 Serour F, Dona G, Birkenfeld S, et al.: Primary neoplasms of the small bowel. Journal of Surgical Oncology 49(1): 29-34, 1992.
Serour F, Dona G, Birkenfeld S, et al.: Primary neoplasms of the small bowel. Journal of Surgical Oncology 49(1): 29-34, 1992.
 Matsuo S, Eto T, Tsunoda T, et al.: Small bowel tumors: an analysis of tumor-like lesions, benign and malignant neoplasms. European Journal of Surgical Oncology 20(1): 47-51, 1994.
Matsuo S, Eto T, Tsunoda T, et al.: Small bowel tumors: an analysis of tumor-like lesions, benign and malignant neoplasms. European Journal of Surgical Oncology 20(1): 47-51, 1994.
 Chow JS, Chen CC, Ahsan H, et al.: A population-based study of the incidence of malignant small bowel tumours: SEER, 1973-1990. International Journal of Epidemiology 25(4): 722-728, 1996.
Chow JS, Chen CC, Ahsan H, et al.: A population-based study of the incidence of malignant small bowel tumours: SEER, 1973-1990. International Journal of Epidemiology 25(4): 722-728, 1996.
CLASIFICACION CELULAR
Intestino delgado:
-adenocarcinoma (mayoría de casos)
-linfoma (poco común) generalmente de tipo no Hodgkin
-sarcoma (más comúnmente leiomiosarcoma y, rara vez, angiosarcoma o liposarcoma)
-carcinoide (Para mayor información, ver el sumario del PDQ sobre el tratamiento del tumor carcinoide gastrointestinal.)
Los neoplasmas malignos del intestino delgado son principalmente (> o = 50%) adenocarcinomas, y son más comunes en el duodeno y en el yeyuno que en el íleon. Los carcinomas del intestino delgado pueden ocurrir sincrónica o metacrónicamente en sitios múltiples.
Los leiomiosarcomas ocurren con mayor frecuencia en el íleon.
Un 20% de las lesiones malignas del intestino delgado son tumores carcinoides, los cuales ocurren con más frecuencia en el íleon que en el duodeno o el yeyuno y pueden ser múltiples.
Es poco común encontrar un linfoma maligno como una lesión solitaria del intestino delgado.
Bibliografía:
 Small intestine. In: American Joint Committee on Cancer: AJCC Cancer Staging Manual. Philadelphia, Pa: Lippincott-Raven Publishers, 5th ed., 1997, pp 77-81.
Small intestine. In: American Joint Committee on Cancer: AJCC Cancer Staging Manual. Philadelphia, Pa: Lippincott-Raven Publishers, 5th ed., 1997, pp 77-81.
INFORMACION DE LAS ETAPAS
Las secciones de tratamiento de este sumario están organizadas de acuerdo al tipo histopatológico en lugar de estar organizadas en etapas.
El Comité Americano Conjunto sobre el Cáncer (AJCC por sus siglas en inglés) ha designado las etapas mediante clasificación de TNM.
-- Definiciones de TNM --
Tumor primario (T)
TX: No puede evaluarse el tumor primario
T0: No hay evidencia de tumor primario
Tis: Carcinoma in situ
T1: Tumor invade lamina propia o submucosa
T2: Tumor invade muscularis propia
T3: Tumor invade a través de la muscularis propia a la subserosa o al tejido perimuscular no peritonealizado (mesenterio o retroperitóneo) con extensión de 2 cm o menos*
T4: El tumor perfora el peritoneo visceral o invade directamente otros órganos o estructuras (incluyendo otras asas del intestino delgado, mesenterio, o retroperitoneo más de 2 cm, y la pared abdominal por medio de la serosa; para el duodeno solamente, incluye invasión del páncreas)
*Nota: El tejido perimuscular no peritonealizado es, para el yeyuno e íleon,parte del mesenterio y, para el duodeno en áreas donde falta serosa, parte delretroperitoneo.
Ganglios linfáticos regionales (N)
NX: No pueden evaluarse los ganglios linfáticos regionales
N0: No hay metástasis a los ganglios linfáticos regionales
N1: Metástasis a los ganglios linfáticos regionales
Metástasis distante (M)
MX: La metástasis distante no puede evaluarse
M0: No hay metástasis distantes
M1: Metástasis distante
-- Grupo de etapas de la AJCC --
-- Etapa 0 -- Tis, N0, M0
-- Etapa I -- T1, N0, M0- T2, N0, M0
-- Etapa II -- T3, N0, M0 - T4, N0, M0
-- Etapa III -- - Cualquier T, N1, M0
-- Etapa IV -- Cualquier T, Cualquier N, M1
Bibliografía:
 Small intestine. In: American Joint Committee on Cancer: AJCC Cancer Staging Manual. Philadelphia, Pa: Lippincott-Raven Publishers, 5th ed., 1997, pp 77-81.
Small intestine. In: American Joint Committee on Cancer: AJCC Cancer Staging Manual. Philadelphia, Pa: Lippincott-Raven Publishers, 5th ed., 1997, pp 77-81.
ASPECTOS DE LAS OPCIONES DE TRATAMIENTO
Las designaciones en PDQ que indican que un tratamiento es "estándar" o que está "en evaluación clínica" no deben emplearse como base para determinar reembolsos.
ADENOCARCINOMA DEL INTESTINO DELGADO ´ Opciones de tratamiento:
Estándar:
1. Para enfermedad primaria resecable: resección quirúrgica radical.
2. Para la enfermedad primaria irresecable: desvío quirúrgico de la lesión obstructora radioterapia paliativa.
En evaluación clínica:
1. Para la enfermedad primaria irresecable: pruebas clínicas que evalúan métodos para mejorar el control local,
tales como el uso de radioterapia con radiosensibilizadores con o sin quimioterapia sistémica.
2. Para la enfermedad metastática irresecable: pruebas clínicas que evalúan el valor que tienen los fármacos
anticancerosos nuevos y productos biológicos (estudios en fase I y II).
Bibliografía:
 Rose DM, Hochwald SN, Klimstra DS, et al.: Primary duodenal adenocarcinoma: a ten-year experience with 79 patients. Journal of the American College of Surgeons 183(2): 89-96, 1996.
Rose DM, Hochwald SN, Klimstra DS, et al.: Primary duodenal adenocarcinoma: a ten-year experience with 79 patients. Journal of the American College of Surgeons 183(2): 89-96, 1996.
LINFOMA DEL INTESTINO DELGADO
Opciones de tratamiento:Estándar:
1. Para la enfermedad localizada en la pared intestinal (etapa IE): resección quirúrgica sola puede bastar si 12 o más ganglios linfáticos son extraídos y se prueba que tienen resultado negativo, pero debe considerarse agregar quimioterapia de combinación o irradiación al tratamiento.
2. Para extensión de la enfermedad a los ganglios linfáticos regionales: resección quirúrgica al momento del diagnóstico. Quimioterapia de combinación es entonces el tratamiento de elección.
3. Para la enfermedad irresecable y extensa: la quimioterapia de combinación es el tratamiento preferido
la radioterapia a menudo se emplea para reducir el riesgo de recidiva en la base del tumor.
Ver el sumario del PDQ sobre el manejo del linfoma.
LEIOMIOSARCOMA DEL INTESTINO DELGADO
Opciones de tratamiento:
Estándar:
1. Para la enfermedad primaria resecable: resección quirúrgica radical.
2. Para la enfermedad primaria irresecable: desvío quirúrgico de la lesión obstructora ,radioterapia.
3. Para la enfermedad metastática irresecable:
- cirugía paliativa
- radioterapia paliativa
- quimioterapia paliativa.
En evaluación clínica:
Para la enfermedad irresecable primaria o metastática:
pruebas clínicas que evalúan el valor que tienen los fármacos anticancerígenos nuevos y los productos biológicos.
CANCER RECURRENTE DEL INTESTINO DELGADO
Opciones de tratamiento:
1. Para adenocarcinoma metastático o leiomiosarcoma:
No hay una quimioterapia eficaz estándar para adenocarcinoma metastático recidivante o leiomiosarcoma del intestino delgado. Todos los pacientes deben ser considerados candidatos para pruebas clínicas que estén evaluando el uso de nuevos fármacos anticancerosos o productos biológicos en pruebas en fase I y II.
2. Para el linfoma:
(Para mayor información, ver el sumario del PDQ sobre el tratamiento del linfoma no Hodgkin.)
3. Para la enfermedad localmente recidivante: cirugía ; radioterapia paliativa ; quimioterapia paliativa
 y pruebas clínicas que estén evaluando las formas de mejorar el control local, tales como el uso de radioterapia con radiosensibilizadores con o sin quimioterapia sistémica.
y pruebas clínicas que estén evaluando las formas de mejorar el control local, tales como el uso de radioterapia con radiosensibilizadores con o sin quimioterapia sistémica.
DR.HORACIO KINAST
 lugar de origen.
lugar de origen.